��Ŀ����
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɣ���ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼ1װ����һ�������N��C��Si���ַǽ���Ԫ�صķǽ�����ǿ���Ƚϵ�ʵ���о�����ͬѧ�������ͼ2װ������֤±��Ԫ�����ʵĵݱ���ɣ�ͼ2�У�A,B,C�����ֱ���մ��NaBr��Һ������ʪ��ĵ���KI��ֽ��ʪ���ֽ����֪������Ũ�������������ܷ�Ӧ����������
��1����ͬѧʵ�飨��ͼ1����ѡ�õ������������Ʒֱ�Ϊ���� 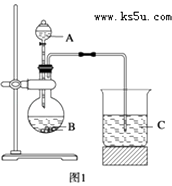
��2����ͬѧʵ�飨��ͼ2���У�A����Ӧ�����ӷ���ʽΪ���� B����ʵ������Ϊ������ʵ�鲻����ȫ֤��±�����ʵĵݱ���ɣ������ԭ�� �� 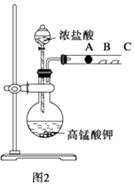
���𰸡�
��1��AΪϡ���ᣬBΪ̼��ƻ�̼�ᱵ��CΪ�����ƻ�������Һ
��2��Cl2+2Br��=Br2+2Cl������ֽ���������������͵⻯�ط�Ӧ�û����ⵥ�ʣ�Ҳʹ���۵⻯����ֽ����������֤����Ԫ�طǽ�����ǿ�ڵ�Ԫ��
���������⣺��1�����������Ϣ����ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼ1װ����һ�������ͬ����Ԫ�طǽ�����ǿ���Ƚϵ�ʵ���о������������ǿ��̼�ᣬ̼������ǿ�ڹ��ᣬ����������Ӧˮ��������Խǿ����ԭ�ӵķǽ�����Խǿ������AΪϡ���ᣬBΪ̼��ƻ�̼�ᱵ��CΪ�����ƻ�������Һ�����Դ��ǣ�AΪϡ���ᣬBΪ̼��ƻ�̼�ᱵ��CΪ�����ƻ�������Һ����2��A,B,C�����ֱ���մ��NaBr��Һ������ʪ��ĵ���KI��ֽ��ʪ���ֽ���������������ԣ��ܽ������ӡ�����������Ϊ��Ӧ�ĵ��ʣ���A����Ӧ�����ӷ���ʽΪ��Cl2+2Br��=2Cl��+Br2��B�������������������ɵⵥ�ʣ���Ӧ�����ӷ���ʽΪ��Cl2+2I��=2Cl��+I2 �� ����B��������Ϊ��ֽ�����������������ܹ����ⵥ�������ɵⵥ�ʣ��Ӷ�ʹ���۵⻯����ֽ�����������˼�����������֤����Ԫ�طǽ�����ǿ�ڵ�Ԫ�أ����Դ��ǣ�Cl2+2Br��=Br2+2Cl������ֽ���������������͵⻯�ط�Ӧ�û����ⵥ�ʣ�Ҳʹ���۵⻯����ֽ����������֤����Ԫ�طǽ�����ǿ�ڵ�Ԫ�أ�

 ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�����Ŀ����ΪԪ�����ڱ���һ���֣�
�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | |
һ | �� | |||||||
�� | �� | �� | �� | �� | �� | |||
�� | �� | �� | �� | �� | ||||
�� | ||||||||
��1������Ԫ���ķǽ�������ǿ��Ԫ���Ľ�������ǿ��Ԫ���ĵ��������³�Һ̬����дԪ�ط��ţ���
��2������Ԫ�آߵ�ԭ�ӽṹʾ��ͼΪ
��3������Ԫ�آޢ��⻯����ȶ���˳��Ϊ������д��ѧʽ����ͬ����
��4������Ԫ�آ������������Ӧˮ��������ԣ��� ��
��5������Ԫ�آں͢�����������Ӧˮ����ļ����� ��

