题目内容
【题目】计算
(1)2.33gBaSO4的物质的量________mol。
(2)标准状况下6.72L N2的物质的量________mol。
(3)等质量的O2与O3在同温同压下的体积之比_______。
(4)同温同压同体积的CO2与SO2的质量之比________。
(5)同温同压下条件下CO与CO2的密度之比_________。
【答案】 0.01 0.3 3:2 11:16 7:11
【解析】(1)2.33gBaSO4的物质的量n=![]() =
=![]() =0.01mol,故答案为:0.01;
=0.01mol,故答案为:0.01;
(2)标准状况下6.72L N2的物质的量n=![]() =
=![]() =0.3mol,故答案为:0.3;
=0.3mol,故答案为:0.3;
(3)同温同压下的气体的体积之比等于物质的量之比,等质量的O2与O3在同温同压下的体积之比,设二者的质量均为m,则O2与O3的体积之比=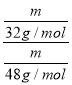 =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(4)同温同压同体积的CO2与SO2的物质的量相等,设二者的物质的量均为n,CO2与SO2的质量之比=n×44g/mol:n×64g/mol=11:16,故答案为:11:16;
(5)同温同压下,气体摩尔体积相等,根据ρ=![]() 知,相同条件下密度之比等于其摩尔质量之比=28g/mol:44g/mol=7:11,故答案为: 7:11。
知,相同条件下密度之比等于其摩尔质量之比=28g/mol:44g/mol=7:11,故答案为: 7:11。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案
相关题目