题目内容
12.下列物质中,含极性共价键的化合物是( )| A. | NaCl | B. | Cl2 | C. | HCl | D. | H2 |
分析 同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.NaCl中只存在离子键,属于离子化合物,故A错误;
B.氯气分子中Cl-Cl原子之间只存在非极性键,属于单质,故B错误;
C.HCl分子中H-Cl原子之间只存在极性键,属于共价化合物,故C正确;
D.氢气分子中H-H原子之间只存在非极性键,属于单质,故D错误;
故选C.
点评 本题考查化学键和化合物判断,为高频考点,侧重考查基本概念,知道物质构成微粒、微粒之间作用力是解本题关键,知道化合物和化学键的关系,题目难度不大.

练习册系列答案
相关题目
2.N2O5是一种新型绿色硝化剂.用硼氢化钠(NaBH4)燃料电池做电源,电解法制备N2O5的装置简图如下(隔膜只允许H+ 通过).

回答下列问题:
(1)电池负极反应式是BH4-+8OH--8e-=BO2-+6H2O,电解池阳极生成N2O5的电极反应式是N2O4+2HNO3-2e-=2N2O5+2H+.
(2)隔膜不允许水分子通过的原因是H2O 通过隔膜进入阳极,与N2O5反应生成HNO3.N2O5在一定温度下可发生分解反应:2N2O5 (g)?2N2O4(g)+O2(g)△H>0,t℃时,向一定容积的密闭容器中通入N2O5(g),部分实验数据见下表:
(3)500s 时,c(O2)=1.375 mol?L-1.
(4)t℃时,该反应平衡常数K值为1.25.
(5)下列措施能降低N2O5分解率的是③④⑤.
①升温 ②通入N2 ③通入O2 ④通入N2O5 ⑤NO2.

回答下列问题:
(1)电池负极反应式是BH4-+8OH--8e-=BO2-+6H2O,电解池阳极生成N2O5的电极反应式是N2O4+2HNO3-2e-=2N2O5+2H+.
(2)隔膜不允许水分子通过的原因是H2O 通过隔膜进入阳极,与N2O5反应生成HNO3.N2O5在一定温度下可发生分解反应:2N2O5 (g)?2N2O4(g)+O2(g)△H>0,t℃时,向一定容积的密闭容器中通入N2O5(g),部分实验数据见下表:
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 2.25 | 2.50 | 2.50 |
(4)t℃时,该反应平衡常数K值为1.25.
(5)下列措施能降低N2O5分解率的是③④⑤.
①升温 ②通入N2 ③通入O2 ④通入N2O5 ⑤NO2.
3.已知S和Cl两种元素均位于第三周期,则( )
| A. | 原子半径:S<Cl | |
| B. | 元素非金属性:S>Cl | |
| C. | 氢化物的稳定性:H2S>HCl | |
| D. | 最高价氧化物对应水化物的酸性:H2SO4<HClO4 |
20.下列说法错误的是( )
| A. | 通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐 | |
| B. | 若按交叉分类法分类,碳酸钠既属于钠盐,又属于碳酸盐 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
7.下列有关糖类、油脂、蛋白质的说法正确的是( )
| A. | 都能发生水解反应 | B. | 都属于高分子化合物 | ||
| C. | 都属于基本营养物质 | D. | 都只含C、H、O三种元素 |
17.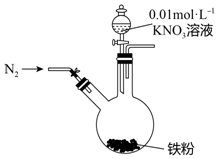 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
(1)通入N2并保持后续反应均在N2氛围中进行的实验目的是防止空气中的O2对Fe和NO3-反应的干扰,避免影响反应产物的判断.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)为了探宄滤液的成分,该同学进一步设计了下述实验:
(i)根据以上实验现象,可以判断滤液中存在NH4+、Fe2+、NO3-离子.
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:| 实验步骤 | 实验现象 |
| 1.打开弹簧夹,缓慢通入N2 | |
| 2.加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着. |
| 3.反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化. |
| 4将剩余固体过滤 | 表面的白色物质变为红褐色. |
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)为了探宄滤液的成分,该同学进一步设计了下述实验:
| 实验步骤 | 实验现象 |
| 1.取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
| 2.将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
| 3.另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸. | 有气体生成,该气体使红色石蕊试纸变蓝. |
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
4.下列实验现象不能说明相关结论的是( )
| A. | 向Al(OH)3沉淀滴加NaOH或盐酸沉淀均消失,说明Al(OH)3是两性氢氧化物 | |
| B. | 饱和Na2S溶液中滴入少量氯水出现浑浊,说明元素非金属性Cl>S | |
| C. | 将铜丝插入锌粒与稀硫酸反应体系中反应明显加快,原因是形成了原电池 | |
| D. | 饱和食盐水中滴入浓硫酸析出食盐晶体,说明浓硫酸吸水放出大量的热 |
1.2005年1月14日“惠更斯”号探测器成功登陆了土卫六,根据发回的照片和数据分析,土卫六“酷似地球经常下雨”,不过“雨”的成份是以液态甲烷为主的一些碳氢化合物.下列说法中,错误的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 甲烷是一种比较洁净的能源 | |
| C. | 石油的主要成分是各种碳氢化合物组成的混合物 | |
| D. | 甲烷的二氯代物无同分异构体 |
2.有关如图所示化合物的说法不正确的是( )


| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1mol该化合物最多可以与3molNaOH反应 | |
| C. | 分子式为C23H24O6 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |