题目内容
【题目】某化工厂排放出大量含硫酸铵的废水,技术人员设计如图所示装置处理废水中的硫酸铵,并回收化工产品硫酸和氨水,废水处理达标后再排放。下列说法错误的是
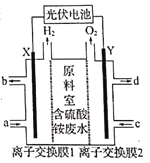
A. 离子交换膜1为阳离子交换膜,Y极发生氧化反应
B. a口进入稀氨水,d口流出硫酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 对含硫酸铵较多的废水处理过程中若转移0.2mol电子,则可回收19.6gH2SO4
【答案】D
【解析】
A、观察装置图可知,处理废水实质上是电解水。X极上产生H2,发生了还原反应,X极为阴极,Y极为阳极,Y极上发生氧化反应。X极的电极反应式为2H2O+2e-= =2OH- +H2↑,硫酸铵电离出的铵根离子向X极迁移,NH4++OH-=NH3H2O,离子交换膜1为阳离子交换膜,选项A正确;
B、a口进入稀氨水,氨水增强水的导电性,Y极产生O2,离子交换膜2为阴离子交换膜,SO42-经过离子交换膜2向Y极迁移,所以c口进入稀硫酸增强导电性,d口流出较浓硫酸,选项B正确;
C、Y极产生O2,在稀硫酸中水参与电极反应,选项C正确;
D、由电极反应式知,转移0.2 mol电子时可生成0.1 mol H2SO4,即生成9.8g H2SO4,选项D错误。
答案选D。

练习册系列答案
相关题目


