题目内容
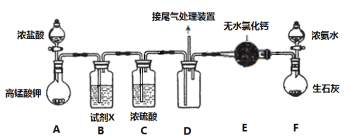
【题目】某化学小组经查阅资料得知常温下过量的氨气和氯气能反应生成氯化铵,该实验小组对该反应进行探究,部分实验装置如下(夹持装置略去)
回答下列问题
(1)装置F是NH3的制备装置,其中盛放浓氨水的仪器名称是___________,再写出一种在实验室制备NH3的反应原理(用化学方程式表示)____________。
(2)某同学认为应将E中的无水氯化钙换成碱石灰,他的理由______________。
(3)装置A中发生反应的离子方程式为___________。
(4)装置B中盛装的试剂X的名称为_________,该装置的作用为__________。
(5)装置D的设计中有明显不足之处,请提出改进意见______________。
(6)某同学设计实验证明装置D中所得固体为氯化铵,请把实验步骤写完整:
①取少量装置D中所得固体产物配成溶液,并取少量溶液于两支试管中;
②__________________________;
③向另一只试管中加过量稀硝酸,再加AgNO3溶液,有白色沉淀生成,结论:常温下过量的氨气和氯气反应可生成氯化铵。
【答案】分液漏斗 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 无水氯化钙会吸收反应生成的NH3 2
CaCl2+2NH3↑+2H2O 无水氯化钙会吸收反应生成的NH3 2![]() +10Cl-+16H+=2Mn2++5Cl2↑+8H2O 饱和食盐水 除去Cl2中的HCl,防止其与NH3反应生成NH4Cl干扰试验 将左侧短导管和右侧长导管互换 将三个导管均换成粗导管 向其中一只试管中加入NaOH浓溶液并加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝
+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 饱和食盐水 除去Cl2中的HCl,防止其与NH3反应生成NH4Cl干扰试验 将左侧短导管和右侧长导管互换 将三个导管均换成粗导管 向其中一只试管中加入NaOH浓溶液并加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝
【解析】
根据装置:A中制备氯气,反应为:2![]() +10Cl-+16H+=2Mn2++5Cl2↑+8H2O,生成的氯气中混有HCl和水蒸气,为防止氨气和HCl反应干扰实验,B中盛放饱和食盐水除去HCl,C中浓硫酸干燥氯气,F中制备氨气,E中无水氯化钙干燥生成的氨气,但无水氯化钙同时会吸收氨气,可以换成碱石灰,干燥的氯气与氨气在D中反应,氯气的密度比氨气大,为使其充分接触反应,氯气的导气管应短进,氨气的导气管应长进,生成的氯化铵可用浓NaOH检验铵根离子,用硝酸银检验氯离子,据此分析作答。
+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,生成的氯气中混有HCl和水蒸气,为防止氨气和HCl反应干扰实验,B中盛放饱和食盐水除去HCl,C中浓硫酸干燥氯气,F中制备氨气,E中无水氯化钙干燥生成的氨气,但无水氯化钙同时会吸收氨气,可以换成碱石灰,干燥的氯气与氨气在D中反应,氯气的密度比氨气大,为使其充分接触反应,氯气的导气管应短进,氨气的导气管应长进,生成的氯化铵可用浓NaOH检验铵根离子,用硝酸银检验氯离子,据此分析作答。
(1)装置F是NH3的制备装置,其中盛放浓氨水的仪器为分液漏斗,实验室可以用氯化铵和氢氧化钙制备氨气,反应为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)因为无水氯化钙会吸收反应生成的氨气,故应将E中的无水氯化钙换成碱石灰,碱石灰可以干燥氨气;
(3)装置A为酸性高锰酸钾与浓盐酸制备氯气,离子反应方程式为:2![]() +10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(4)装置A中制备的氯气混有HCl,HCl与氨气反应,故B中生成饱和食盐水吸收HCl,除去Cl2中HCl,防止其与NH3反应生成NH4Cl干扰试验;
(5)氯气的密度比氨气大,为使其充分接触反应,氯气的导气管应短进,氨气的导气管应长进,故应将左侧短导管和右侧长导管互换,并将三个导管均换成粗导管;
(6)证明装置D中所得固体为氯化铵,分别用浓的NaOH溶液检验铵根离子,硝酸银溶液检验氯离子,故步骤为:
①取少量装置D中所得固体产物配成溶液,并取少量溶液于两支试管中;
②向其中一支试管中加入NaOH浓溶液并加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝;
③向另一支试管中加过量稀硝酸,再加AgNO3溶液,有白色沉淀生成。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案