题目内容
铜及铜的化合物有多种应用.请回答下面相关问题:(1)下列两种方法均可以制备CuSO4
①2Cu+O2
 2CuO CuO+H2SO4=CuSO4+H2O ②Cu+2H2SO4(浓)
2CuO CuO+H2SO4=CuSO4+H2O ②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O假如某工厂欲生产CuSO4,请选择一种方法并说明理由______.
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因______ 2CuSO4+2H2O
【答案】分析:(1)根据原料利用率和环保的角度;
(2)根据溶液中有氧气参加反应及H2O2的氧化性来分析;
(3)根据盖斯定律计算反应热;
(4)根据氧化还原反应中化合价升降总数相等及质量守恒来配平;
(5)根据Cu2S和CuS加热后最终都变成CuO,建立方程组求解.
解答:解:(1)方法①中Cu、H2SO4的利用率100%,且无污染,方法②中Cu的利用率100%,H2SO4的利用率50%,且产生污染物,故答案:选择方法①原料利用率高,污染少;
(2)因溶液中有氧气,加热能与铜反应生成氧化铜:2Cu+O2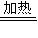 2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加:2Cu+O2+2H2SO4
2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加:2Cu+O2+2H2SO4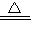 2CuSO4+2H2O,因加热时滴入几滴
2CuSO4+2H2O,因加热时滴入几滴
H2O2,溶液也会很快呈蓝色,说明H2O2能讲铜氧化成铜离子,离子反应为Cu+H2O2+2H+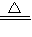 Cu2++2H2O,故答案:2Cu+O2+2H2SO4
Cu2++2H2O,故答案:2Cu+O2+2H2SO4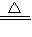 2CuSO4+2H2O;Cu+H2O2+2H+
2CuSO4+2H2O;Cu+H2O2+2H+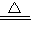 Cu2++2H2O;
Cu2++2H2O;
(3)已知:2Cu(s)+ O2(g)=Cu2O(s);△H1=-12.0kJ/mol ①
O2(g)=Cu2O(s);△H1=-12.0kJ/mol ①
2Cu(s)+S(s)=Cu2S(s);△H2=-79.5kJ/mol ②
S(s)+O2 (g)=SO2(g);△H3=-296.83kJ/mol ③
根据盖斯定律③-①×2-②可得Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g);△H4=-193.33kJ/mol,
故答案为:-193.33;
(4)根据化合价升降总数相等可知,
Cu2S Cu:+1→+2↑2 共↑10×3
S:-2→+6↑8
HNO3 N:+5→+2↓3×10
则配平后的化学反应为3Cu2S+16HNO3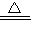 3CuSO4+3Cu(NO3)2+10NO↑+8H2O,
3CuSO4+3Cu(NO3)2+10NO↑+8H2O,
故答案:3,16,3,3,10,8H2O;
(5)设Cu2S 的质量为x,CuS 的质量为y,
Cu2S~2CuO CuS~CuO
160 160 96 80
x x y y
y
建立方程组: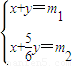
解得:x=6m2-5m1,y=6m1-6m2,
故答案为:6m2-5m1.
点评:本题主要考查了铜的化学性质,同时也考查了盖斯定律的运用,氧化还原反应,增加了试题的综合性.
(2)根据溶液中有氧气参加反应及H2O2的氧化性来分析;
(3)根据盖斯定律计算反应热;
(4)根据氧化还原反应中化合价升降总数相等及质量守恒来配平;
(5)根据Cu2S和CuS加热后最终都变成CuO,建立方程组求解.
解答:解:(1)方法①中Cu、H2SO4的利用率100%,且无污染,方法②中Cu的利用率100%,H2SO4的利用率50%,且产生污染物,故答案:选择方法①原料利用率高,污染少;
(2)因溶液中有氧气,加热能与铜反应生成氧化铜:2Cu+O2
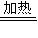 2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加:2Cu+O2+2H2SO4
2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加:2Cu+O2+2H2SO4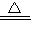 2CuSO4+2H2O,因加热时滴入几滴
2CuSO4+2H2O,因加热时滴入几滴H2O2,溶液也会很快呈蓝色,说明H2O2能讲铜氧化成铜离子,离子反应为Cu+H2O2+2H+
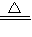 Cu2++2H2O,故答案:2Cu+O2+2H2SO4
Cu2++2H2O,故答案:2Cu+O2+2H2SO4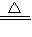 2CuSO4+2H2O;Cu+H2O2+2H+
2CuSO4+2H2O;Cu+H2O2+2H+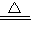 Cu2++2H2O;
Cu2++2H2O; (3)已知:2Cu(s)+
 O2(g)=Cu2O(s);△H1=-12.0kJ/mol ①
O2(g)=Cu2O(s);△H1=-12.0kJ/mol ①2Cu(s)+S(s)=Cu2S(s);△H2=-79.5kJ/mol ②
S(s)+O2 (g)=SO2(g);△H3=-296.83kJ/mol ③
根据盖斯定律③-①×2-②可得Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g);△H4=-193.33kJ/mol,
故答案为:-193.33;
(4)根据化合价升降总数相等可知,
Cu2S Cu:+1→+2↑2 共↑10×3
S:-2→+6↑8
HNO3 N:+5→+2↓3×10
则配平后的化学反应为3Cu2S+16HNO3
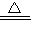 3CuSO4+3Cu(NO3)2+10NO↑+8H2O,
3CuSO4+3Cu(NO3)2+10NO↑+8H2O,故答案:3,16,3,3,10,8H2O;
(5)设Cu2S 的质量为x,CuS 的质量为y,
Cu2S~2CuO CuS~CuO
160 160 96 80
x x y
 y
y 建立方程组:
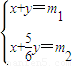
解得:x=6m2-5m1,y=6m1-6m2,
故答案为:6m2-5m1.
点评:本题主要考查了铜的化学性质,同时也考查了盖斯定律的运用,氧化还原反应,增加了试题的综合性.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
 2CuO CuO+H2SO4=CuSO4+H2O ②Cu+2H2SO4(浓)
2CuO CuO+H2SO4=CuSO4+H2O ②Cu+2H2SO4(浓) O2(g)=Cu2O(s);△H1=-12.0kJ/mol
O2(g)=Cu2O(s);△H1=-12.0kJ/mol 2CuO CuO+H2SO4=CuSO4+H2O ②Cu+2H2SO4(浓)
2CuO CuO+H2SO4=CuSO4+H2O ②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O