题目内容
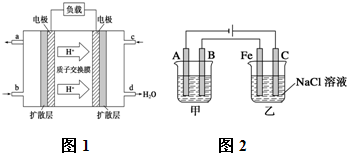
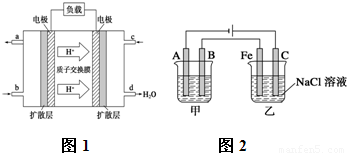
Ⅰ.已知甲醇燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式为
Ⅱ.如图2所示:甲、乙为相互串联的两电解池.试答:
(1)乙池中C极电极反应式为
(2)甲池若为用电解原理精炼铜的装置,则A电极名称为
①该电池工作时,b口通入的物质为
CH3OH
CH3OH
,c口通入的物质为O2
O2
.②该电池负极的电极反应式为
CH3OH+H2O-6e-═CO2+6H+
CH3OH+H2O-6e-═CO2+6H+
.Ⅱ.如图2所示:甲、乙为相互串联的两电解池.试答:
(1)乙池中C极电极反应式为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈红
红
色.(2)甲池若为用电解原理精炼铜的装置,则A电极名称为
阴
阴
极,电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
,溶液可以是CuSO4溶液或CuCl2溶液
CuSO4溶液或CuCl2溶液
.
分析:Ⅰ、在燃料电池中,负极是燃料发生失电子的氧化反应,正极是氧气发生得电子的还原反应;依据氢离子移动方向分析判断,移向的电极为正极;结合原电池的工作原理和电池电解质溶液的环境分析回答问题,书写电极反应,负极失电子反应氧化反应,正极上得到电子发生还原反应;
Ⅱ、(1)依据装置图中的电源正负极判断,A为阴极,B为阳极,Fe为阴极,C为阳极;依据电解原理可知,乙池中阳极为惰性电极,溶液中阴离子在阳极失电子发生氧化反应,阳离子移向阴极,得到电子发生还原反应;
(2)甲池若为用电解原理精炼铜的装置,需要符合,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;
Ⅱ、(1)依据装置图中的电源正负极判断,A为阴极,B为阳极,Fe为阴极,C为阳极;依据电解原理可知,乙池中阳极为惰性电极,溶液中阴离子在阳极失电子发生氧化反应,阳离子移向阴极,得到电子发生还原反应;
(2)甲池若为用电解原理精炼铜的装置,需要符合,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;
解答:解:Ⅰ.①根据装置可以知道d处生成大量的水,氢离子移向的电极为原电池的正极,所以c电极是通入的氧气,b口通入的物质为甲醇,故答案为:CH3OH; O2;
②d处生成大量的水,所以c电极是通入的氧气,为正极,b口通入的物质为甲醇,为负极,正极发生电极反应为:O2+4e-+4H+=2H2O,依据电池总反应为:2CH3OH+3O2=2CO2+4H2O;总化学方程式-正极×3得到负极电极反应为:CH3OH+H2O-6e-═CO2+6H+;故答案为:CH3OH+H2O-6e-═CO2+6H+;
Ⅱ.(1)依据装置图中的电源正负极判断,A为阴极,B为阳极,Fe为阴极,C为阳极;乙池中阳极为惰性电极,溶液中的Cl-放电能力大于OH-,电极反应为:2Cl--2e-═Cl2↑,阴极上是溶液中的阳离子得到电子发生还原反应,溶液中的氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,阴极Fe附近水的电离平衡被破坏,氢氧根离子浓度增大,遇酚酞变红;故答案为:红;
(2)甲池若为用电解原理精炼铜的装置,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;A电极名称为阴极;电解质溶液为 CuSO4溶液或CuCl2溶液;溶液中铜离子得到电子生成铜,电极反应为:Cu2++2e-═Cu;
故答案为:阴; Cu2++2e-═Cu; CuSO4溶液或CuCl2溶液;
②d处生成大量的水,所以c电极是通入的氧气,为正极,b口通入的物质为甲醇,为负极,正极发生电极反应为:O2+4e-+4H+=2H2O,依据电池总反应为:2CH3OH+3O2=2CO2+4H2O;总化学方程式-正极×3得到负极电极反应为:CH3OH+H2O-6e-═CO2+6H+;故答案为:CH3OH+H2O-6e-═CO2+6H+;
Ⅱ.(1)依据装置图中的电源正负极判断,A为阴极,B为阳极,Fe为阴极,C为阳极;乙池中阳极为惰性电极,溶液中的Cl-放电能力大于OH-,电极反应为:2Cl--2e-═Cl2↑,阴极上是溶液中的阳离子得到电子发生还原反应,溶液中的氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,阴极Fe附近水的电离平衡被破坏,氢氧根离子浓度增大,遇酚酞变红;故答案为:红;
(2)甲池若为用电解原理精炼铜的装置,粗铜做阳极,精铜做阴极,含铜离子的电解质溶液;A电极名称为阴极;电解质溶液为 CuSO4溶液或CuCl2溶液;溶液中铜离子得到电子生成铜,电极反应为:Cu2++2e-═Cu;
故答案为:阴; Cu2++2e-═Cu; CuSO4溶液或CuCl2溶液;
点评:本题考查了电化学的知识应用,主要是原电池、电解池的电极名称,电极判断,电极反应,电解精炼的原理应用,要求学生具有分析和解决问题的能力,题目难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
 H2+I2
H2+I2  CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题: 

 H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O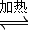 CH3OH(g)分析该反应并回答下列问题:
CH3OH(g)分析该反应并回答下列问题: