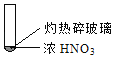题目内容
【题目】对氧原子核外两个未成对电子的描述,正确的是
A. 能量不同B. 自旋方向不同
C. 电子云形状相同D. 在同一轨道上
【答案】C
【解析】
A. 氧原子核外两个未成对电子,都属于2p轨道,能量相同,故A错误;
B. p能级有三个轨道,不同电子优先占据空轨道,并且自旋方向相同,所以氧原子核外两个未成对电子自旋方向相同,故B错误;
C. 氧原子核外两个未成对电子,都属于2p轨道,p轨道沿x、y、z轴的方向电子云密度大,呈现哑铃型,则电子云形状相同,故C正确;
D. p能级有三个轨道,不同电子优先占据空轨道,所以氧原子核外两个未成对电子不在同一轨道,故D错误;
故选C。

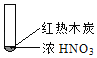
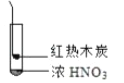
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】氯化铁在现代生产和生活中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做了如下探究实验。

已知:Ⅰ.无水氯化铁在空气中易潮解,加热易升华;
Ⅱ.工业上,向500~600℃的铁屑中通入氯气可生产无水氯化铁;
Ⅲ.向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
请回答下列问题:
(1)装置的连接顺序为 _____________(按气流从左向右的方向,填仪器接口字母)。
(2)装置D的作用是 _________;
若缺少装置E对本实验造成的影响是_________________________________________。
(3)工业生产中,会将装置D中的干燥剂换成无水氯化钙,通过装置D后产生的过量氯气再用氯化亚铁溶液吸收,得到氯化铁溶液作为副产品。氯化亚铁溶液因吸收Cl2失去作用而失效,下列试剂中能够检验氯化亚铁溶液是否完全失效的所用的试剂是_____________。
(4)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验: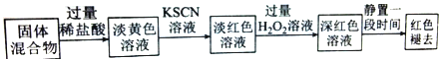
淡红色溶液中加入过量H2O2后溶液红色加深的原因是 __________ (用离子方程式表示)。
实验 | 操作 | 现象 | |
实验甲:取褪色后溶液3等份 | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
第2份 | 滴加KSCN溶液 | 溶液变为红色 | |
第3份 | 滴加稀盐酸和BaCl2 | 产生白色沉淀 | |
实验乙:取与褪色后溶液同浓度的FeCl3溶液 | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
根据实验现象判断,以下说法不正确的是 _____(填选项字母)。
A. 实验甲说明是Fe3+发生了反应而不是SCN—发生反应
B. 实验甲说明是SCN—发生了反应而不是Fe3+发生反应
C.实验甲中第3份溶液中生成的白色沉淀为BaSO4
D.实验乙排除H2O2分解产生的O2氧化SCN—的可能
由实验甲和乙得出的结论为______________________________ 。
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1=-285.8kJ/mol
C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH3=-5518kJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
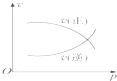
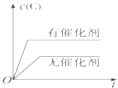
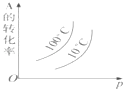
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图所示。
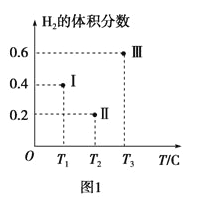

①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为__________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
③工业实际合成CH3OH生产中,采用图2中M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由_________________________。