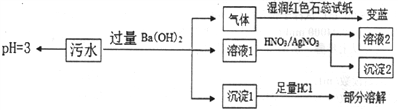
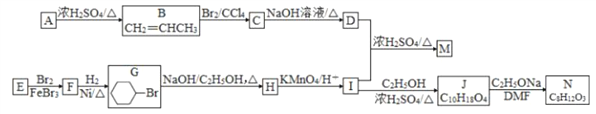
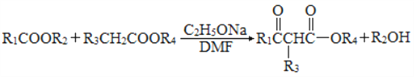题目内容
【题目】某同学用质量分数为36.5%,密度为116g/cm3的浓盐酸配制240mL 1mol/L的稀盐酸。请回答下列问题:
(1)需要量取浓盐酸______mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有______。
(3)在配制过程中,若用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度将______(填“偏高”、“偏低”、“无影响”,下同)。若量取的浓盐酸经稀释、冷却至室温,注入用蒸馏水洗涤后未干燥的容量瓶中,则配制的稀盐酸浓度将_______。若定容时俯视观察凹液面最低点与刻线相平,则配制的稀盐酸浓度将为_______。若用该方法配制氢氧化钠溶液,则操作过程中动作要快,否则会造成浓度___;试分析造成此变化的原因是_______。
(4)若在标准状况下,将VLHCl气体溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,则所得盐酸溶液的物质的量浓度为_______mol/L。
【答案】 21.6 250mL容量瓶、胶头滴管、玻璃棒(可颠倒) 偏低 无影响 偏高 偏低 NaOH易潮解、易吸收空气中的CO2而变质 ![]()
【解析】(1)浓盐酸的物质的量浓度c(HCl)=![]() =
=![]() mol·L-1=11.6mol·L-1,设所需浓硫酸的体积为V,则有V×11.6mol·L-1=0.25L×1mol·L-1,则
mol·L-1=11.6mol·L-1,设所需浓硫酸的体积为V,则有V×11.6mol·L-1=0.25L×1mol·L-1,则
V=![]() =0.0216L=21.6mL;(2)根据操作步骤:计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用30mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.所以还需要的仪器为:玻璃棒、胶头滴管、250mL容量瓶。(3)在配制过程中,若用刚刚洗涤洁净的量筒来量取浓盐酸,量筒壁上的水导致浓盐酸浓度减少,所量取溶液中溶质的质量减少,其配制的稀盐酸浓度将偏低。若量取的浓盐酸经稀释、冷却至室温,注入用蒸馏水洗涤后未干燥的容量瓶中,对溶质的物质的量和最终溶液的体积没有影响,浓度不变。若定容时俯视观察凹液面最低点与刻线相平,溶液体积偏大,则配制的稀盐酸浓度将偏低。若用该方法配制氢氧化钠溶液,则操作过程中动作要快,否则会造成浓度偏低;试分析造成此变化的原因是NaOH易潮解、易吸收空气中的CO2而变质。(4)根据V=
=0.0216L=21.6mL;(2)根据操作步骤:计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用30mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.所以还需要的仪器为:玻璃棒、胶头滴管、250mL容量瓶。(3)在配制过程中,若用刚刚洗涤洁净的量筒来量取浓盐酸,量筒壁上的水导致浓盐酸浓度减少,所量取溶液中溶质的质量减少,其配制的稀盐酸浓度将偏低。若量取的浓盐酸经稀释、冷却至室温,注入用蒸馏水洗涤后未干燥的容量瓶中,对溶质的物质的量和最终溶液的体积没有影响,浓度不变。若定容时俯视观察凹液面最低点与刻线相平,溶液体积偏大,则配制的稀盐酸浓度将偏低。若用该方法配制氢氧化钠溶液,则操作过程中动作要快,否则会造成浓度偏低;试分析造成此变化的原因是NaOH易潮解、易吸收空气中的CO2而变质。(4)根据V=![]() =
= ,则c=
,则c=![]() =
= =
= mol·L-1。
mol·L-1。