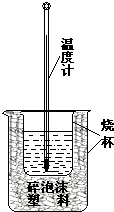
��Ŀ����
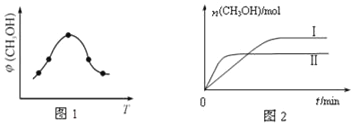
����Ŀ����2 L���ܱ������з�����ӦxA(g)��yB(g)![]() zC(g)��ͼ�ױ�ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ�ұ�ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���ǣ� ����
zC(g)��ͼ�ױ�ʾ200 ��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ�ұ�ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A)��n(B)�ı仯��ϵ�������н�����ȷ���ǣ� ����

A. 200 ��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v(B)��0.04 mol��L��1��min��1
B. 200��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ25 L2/mol2
C. �����������200�����µ�100����ԭƽ��һ�����ƻ��������淴Ӧ���ʾ�����
D. ��ͼ�ҿ�֪����ӦxA(g)��yB(g)![]() zC(g)����H<0����a��2
zC(g)����H<0����a��2
���𰸡�B
����������ͼ��֪����Ӧ��A��B��C�����ʵ����ı仯��Ϊ0.4��0.2��0.2=2��1��1�����ݷ�Ӧ�м�����֮�ȵ������ʵ����ʵ����ı仯��֮�ȿ�֪���÷�Ӧ����ʽΪ��2A��g��+B��g��![]() C��g����A������v=
C��g����A������v=![]() ��֪v��B��=
��֪v��B��=![]() molL-1min-1=0.02molL-1min-1����A����B����ͼ��֪ƽ��ʱA��B��C�����ʵ����ֱ�Ϊ0.4mol��0.2mol��0.2mol���������ǵ�Ũ�ȷֱ�Ϊ��0.2mol/L��0.1mol/L��0.1mol/L����ϻ�ѧ����ʽ2A��g��+B��g��
molL-1min-1=0.02molL-1min-1����A����B����ͼ��֪ƽ��ʱA��B��C�����ʵ����ֱ�Ϊ0.4mol��0.2mol��0.2mol���������ǵ�Ũ�ȷֱ�Ϊ��0.2mol/L��0.1mol/L��0.1mol/L����ϻ�ѧ����ʽ2A��g��+B��g��![]() C��g������֪�÷�Ӧ��ƽ�ⳣ��Ϊ
C��g������֪�÷�Ӧ��ƽ�ⳣ��Ϊ![]() L2/mol2=25L2/mol2����B��ȷ��C������ͼ�ҿ�֪�������¶ȣ�C�������������ƽ�������ƶ�����������ӦΪ���ȷ�Ӧ�����������¶�ƽ�������ƶ���ͬʱ��Ӧ��������C����D������ͼ�ҿ�֪�������¶ȣ�C�������������ƽ�������ƶ�����������ӦΪ���ȷ�Ӧ����H��0����Ͷ��ķ�Ӧ������ʵ���֮�ȵ��ڻ�ѧ��Ӧ�м�����֮��ʱ��ƽ��ʱC��������������ֵ�����ݻ�ѧ����ʽ2A��g��+B��g��C��g������֪a=2����D����ѡB��
L2/mol2=25L2/mol2����B��ȷ��C������ͼ�ҿ�֪�������¶ȣ�C�������������ƽ�������ƶ�����������ӦΪ���ȷ�Ӧ�����������¶�ƽ�������ƶ���ͬʱ��Ӧ��������C����D������ͼ�ҿ�֪�������¶ȣ�C�������������ƽ�������ƶ�����������ӦΪ���ȷ�Ӧ����H��0����Ͷ��ķ�Ӧ������ʵ���֮�ȵ��ڻ�ѧ��Ӧ�м�����֮��ʱ��ƽ��ʱC��������������ֵ�����ݻ�ѧ����ʽ2A��g��+B��g��C��g������֪a=2����D����ѡB��