题目内容
【题目】降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。
CH3OH(g)+ H2O(g) △H<0。
CH3OH的浓度随时间变化如图。回答有关问题:

①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________
②从30分钟到35分钟达到新的平衡,改变的条件可能是__________________________
A.增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)_______________
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3![]() Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为:______________________________________
②电解池中产生CH4一极的电极反应式为:_______________________________________。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
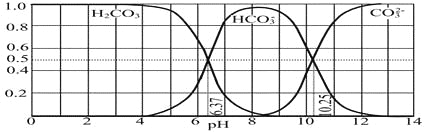
下列叙述正确的是_______________
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
【答案】CH3OH(l)+ O2(g) =CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol 0.075mol/( L·min) D 0.15 mol-2.L2 > 2S22- - 2e-=S42- CO2+8e-+6H2O=CH4+8OH- C D
【解析】
(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也乘以相应的系数并进行相应的计算;
(2)①10min时甲醇的浓度为0.50mol/L,根据化学计量数计算出氢气的浓度变化,再计算出氢气的平均反应速率;
②平衡正向移动了,从影响平衡移动的因素考虑;
③用三段式法求算,代入K的计算公式计算即可,K=![]() ;
;
④从浓度和平衡移动的角度分析;
(3)①电池负极发生氧化反应,化合价升高的物质在负极反应,据此分析;
②CO2转化为甲烷,C的价态有+4价变为-4价,发生还原反应,再注意电解质溶液即可写出电极方程式;
(4)A、由图象可以看出,开始H2CO3浓度最大,CO32-浓度最小,不可能根据1.0 molL-1HCl溶液滴定1.0 molL-1碳酸钠溶液的实验数据绘出;
B、由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-);
C、由图可知,pH为7.4时,HCO3-的最大;
D、在PH为7~9时,溶液中多以HCO3-形式存在。
(1)根据盖斯定律:(①-②+③×4)×0.5整理可得CH3OH(l)+ O2(g)=CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol ;
(2)①从反应开始到20分钟时,CH3OH的平均反应速率v(CH3OH)= ![]() =0.025mol/(L·min),根据方程式可得:v(H2):v(CH3OH)=3:1.所以v(H2)=0.075mol/(L·min);
=0.025mol/(L·min),根据方程式可得:v(H2):v(CH3OH)=3:1.所以v(H2)=0.075mol/(L·min);
②从30分钟到35分钟达到新的平衡,c(CH3OH)增大,
A. 从30分钟到35分钟时,若增大压强,需要缩小容器体积,甲醇浓度变化不会逐渐变化,应该立即变化,错误;
B.加入催化剂,使化学反应速率正反应与逆反应改变的倍数相同,因此平衡不发生移动,物质的浓度也不变;
C.升高温度,平衡逆向移动,c(CH3OH)会减小,错误;
D.增大反应物的浓度,平衡正向移动,产生更多的甲醇,使其浓度增大,正确;
故答案选D。
③ CO2(g)+3H2(g)CH3OH(g)+H2O(g)(各物质浓度mol/L)
反应前 1 3 0 0
反应了 0.70 0.21 0.70 0.70
平衡后 0.30 0.79 0.70 0.70
K= ![]() =
=![]() =0.15mol-2L2;
=0.15mol-2L2;
故答案为:0.15 mol-2.L2;
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,若平衡不发生移动,则CH3OH的浓度应该是1mol/L。但是增大浓度的同时,容器的压强也增大,增大压强,平衡向气体体积减小的方向即向正反应方向移动,因此CH3OH的浓度大于1mol/L;
(3)①根据电池总反应式可知该电池负极是Na2S2。该电极的反应式是2S22- - 2e-=S42- ;
②由于是使CO2在铜电极上可转化为甲烷,C原子得到电子。所以在电解池中产生CH4一极(即阴极)的电极反应式为:CO2+8e-+6H2O=CH4+8OH-;
(4)A.该图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,错误;
B.有分布示意图可知:在pH为6.37溶液中c(H2CO3)=c(HCO3-);在pH=10.25时,溶液中c(HCO3-)=c(CO32-
C.人体血液的pH约为7.4,则根据微粒的存在与溶液的pH关系可知:CO2在血液中多以HCO3-形式存在,正确;
D.由于在溶液的pH为7~9之间时含C微粒主要以HCO3-存在,所以若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间,正确;
故答案选CD。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案