题目内容
【题目】将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是
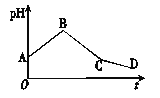
A. A点pH小于7是因为Cu2+水解使溶液显酸性
B. C点的pH比A点的pH小
C. BC段阳极产物是H2
D. CD段电解的物质是H2O
【答案】C
【解析】设CuSO4的和NaCl各1mol,由题意,结合图像可得,电解分3个阶段,第一阶段:阳极:1mol氯离子失1mol电子,阴极:0.5mol铜离子得1mol电子,因为溶液显酸性是铜离子水解的原因,所以铜离子减少,使溶液酸性减弱,pH值增大;第二阶段:阳极:1mol氢氧根离子失1mol电子(来源于水的电离),阴极:0.5mol铜离子得1mol电子,因为氢氧根离子消耗,所以水溶液中氢离子浓度增大,pH值迅速减小;第三阶段:阳极:氢氧根离子失电子,阴极:氢离子得电子,他们都来源于水的电离,但电解过程中水消耗了,使溶液中氢离子浓度增大,pH值减小;A项,A点为硫酸铜和NaCl混合溶液,其中硫酸铜为强酸弱碱盐,水解呈酸性,此时没有进行电解,所以pH小于7,故A正确;B项,A点因为铜离子部分水解而使溶液呈弱酸性,C点溶液中铜离子已全部被还原,此时溶液是硫酸钠和硫酸的混合溶液,溶液酸性增强,所以C点的pH比A点的pH小,故B正确;C项,由上述分析可知,整个过程中阳极先产生Cl2,后产生O2,故C错误;D项,由上述分析,CD段:阳极产生氧气,阴极产生氢气,相当于电解水,故D正确。

练习册系列答案
相关题目