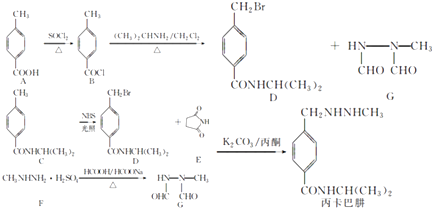
��Ŀ����
����Ŀ������������
��1����ҵ����ȡ�������Ҫ����ͼ��ͼ1�� 
��I����ҵ�ϳɰ���ԭ����N2��H2 �� װ��A��������������N2�ɴӿ����з���������������Ƚ����� �� Ȼ�����ɵõ���H2����ˮ����Ȼ��Ϊԭ���ڴ��������¸�����ȡ���仯ѧ����ʽΪ ��
��II����ԭ�����Ʊ������л��е�CO�Դ����ж������ã�����ȥԭ�����е�CO����ͨ�����·�Ӧ��CO��g��+H2O��g���TCO2��g��+H2��g����ʵ�֣���֪1100Kʱ�÷�Ӧ��ƽ�ⳣ��K=0.64����ҪʹCO��ת���ʳ���80%������ʼ����c��H2O����c��CO�������� ��
��2������ʯ��������ȥ���Ṥҵ��β������NO��NO2�������ܾ���β�������ܻ��Ӧ�ù㷺��Ca��NO2��2 �� �䲿�ֹ���������ͼ2����֪NO��NO2��1��1ͨ���Һ�������������Σ� 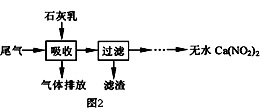
��I�����������в�������Һ�����Ӵ����գ�β�������������룬ʯ����������������ܣ�����Ŀ������������ѭ��ʹ�ã���������Ҫ�ɷ������ѧʽ����
��II���ù��������NO ��NO2 ���ʵ���֮�Ƚӽ�1��1����n��NO����n��NO2����1��1����ᵼ������n��NO����n��NO2����1��1����ᵼ�� ��
���𰸡�
��1���ϳ�����Һ������������N2�ķе����������CH4+H2O��g�� ![]() CO+3H2��5.8
CO+3H2��5.8
��2��ʹβ���е�NO��NO2 ��������գ�Ca��OH��2���ŷ�������NO �������ߣ���ƷCa��NO2��2 ��Ca��NO3��2 ��������
���������⣺��1����I��N2��H2�ϳɰ����ںϳ����н��еģ�����N2���Ʊ����ǽ�����Һ����Ȼ�����������߿���N2�е���������Ƶã���Ӧ�����������Ѿ�������ֻ��д���������ƽ��Ӧ����ʽΪCH4+H2O��g�� ![]() CO+3H2 �� ���Դ��ǣ��ϳ�����Һ������������N2�ķе����������CH4+H2O��g��
CO+3H2 �� ���Դ��ǣ��ϳ�����Һ������������N2�ķе����������CH4+H2O��g�� ![]() CO+3H2����II����c��H2O����c��CO��ΪX�������ʼc��H2O��ΪX����c��CO��Ϊ����CO��g��+H2O��g���TCO2��g��+H2��g����֪��ҪʹCOת���ʴﵽ0.8����ƽ��ʱ�����ʵ�Ũ��Ϊc��CO��=0.2�� c��H2O��=X��0.8��c��CO2��=0.8��c��H2��=0.8����ƽ�ⳣ��K=
CO+3H2����II����c��H2O����c��CO��ΪX�������ʼc��H2O��ΪX����c��CO��Ϊ����CO��g��+H2O��g���TCO2��g��+H2��g����֪��ҪʹCOת���ʴﵽ0.8����ƽ��ʱ�����ʵ�Ũ��Ϊc��CO��=0.2�� c��H2O��=X��0.8��c��CO2��=0.8��c��H2��=0.8����ƽ�ⳣ��K= ![]() ���ɽ��X=5.8��
���ɽ��X=5.8��
���Դ��ǣ�5.8����2����I��ʹ���������ĺô������ڣ�����β��������Һ֮��Ӵ���������Ӷ����β���������ʣ������пɻ������õ��ǹ�����ʯ���飬Ҳ����Ca��OH��2 ��
���Դ��ǣ�ʹβ���е�NO��NO2 ��������գ�Ca��OH��2����II�����Ṥҵβ��NO��NO2һ���ü�Һ���գ�����ӦΪ��NO+NO2+2OH��=2NO2��+H2O������ӦΪ��2NO2+2OH��=NO2��+NO3��+H2O����n��NO����n��NO2����1��1����һ�������������ŷ�������NO�������ߣ���n��NO����n��NO2����1��1���������������������������ʯ���鷴Ӧ����Ca��NO3��2 ��
���Դ��ǣ��ŷ�������NO�������ߣ���ƷCa��NO2��2��Ca��NO3��2�������ߣ�