��Ŀ����
����Ŀ����ν���Է�����ָ�ڷ����У���һ��̼ԭ�������б˴˻�����ͬ���ĸ�ԭ�ӻ�ԭ����ʱ���ƴ˷���Ϊ���Է��ӣ�����̼ԭ��Ϊ����̼ԭ�ӣ�������һ������̼ԭ�ӵ�����һ�����й�ѧ���ԣ����磬�л������ ![]() ���й�ѧ���ԣ�����л�������ֱ������·�Ӧ�����ɵ��л������й�ѧ���Ե��ǣ� ��
���й�ѧ���ԣ�����л�������ֱ������·�Ӧ�����ɵ��л������й�ѧ���Ե��ǣ� ��
A.�����ᷢ��������Ӧ
B.��NaOHˮ��Һ����
C.��������Һ����
D.�ڴ�������������������
���𰸡�C
���������⣺A�� 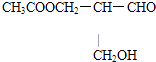 �����ᷢ��������Ӧ����Ӧ�����ɵ�������Cԭ��������������ͬ��CH3COOCH2��ԭ���ţ������й�ѧ���ԣ���A���� B��
�����ᷢ��������Ӧ����Ӧ�����ɵ�������Cԭ��������������ͬ��CH3COOCH2��ԭ���ţ������й�ѧ���ԣ���A���� B�� 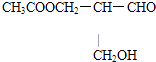 ��NaOH��Һ���ȷ���ˮ�⣬��Ӧ�����ɵ�������Cԭ��������������ͬ�ĩ�CH2OHԭ���ţ������й�ѧ���ԣ���B����
��NaOH��Һ���ȷ���ˮ�⣬��Ӧ�����ɵ�������Cԭ��������������ͬ�ĩ�CH2OHԭ���ţ������й�ѧ���ԣ���B����
C�� 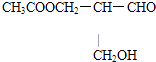 ��������Һ���ñ���������CHO���ɩ�COOH��Cԭ��������4����ͬ��ԭ�ӻ�ԭ���ţ����й�ѧ���ԣ���C��ȷ��
��������Һ���ñ���������CHO���ɩ�COOH��Cԭ��������4����ͬ��ԭ�ӻ�ԭ���ţ����й�ѧ���ԣ���C��ȷ��
D�� 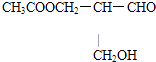 �ڴ�����������H2���ã���CHO���ɩ�CH2OH����Ӧ�����ɵ�������Cԭ��������������ͬ�ĩ�CH2OHԭ���ţ������й�ѧ���ԣ���D����
�ڴ�����������H2���ã���CHO���ɩ�CH2OH����Ӧ�����ɵ�������Cԭ��������������ͬ�ĩ�CH2OHԭ���ţ������й�ѧ���ԣ���D����
��ѡC��

 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�����Ŀ�����������Դ�ǵ����о����ȵ����⣮�����ѣ�CH3OCH3����δ������������ͺ�Һ������Ϊ�ྻҺ��ȼ��ʹ�ã���ҵ����CO��H2Ϊԭ������CH3OCH3 �� ��ҵ�Ʊ��������ڴ���Ӧ���У�ѹ��2.0��10.0Mpa���¶�230��280�棩�������з�Ӧ��
��CO��g��+2H2��g��CH3OH��g����H1=��99kJmol��1
��2CH3OH��g��CH3OCH3��g��+H2O��g����H2=��23.5kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H3=��41.2kJmol��1
��1������Ӧ���е��ܷ�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g���������H= �� ��Ӧԭ������ú����������֪�÷�Ӧ��ƽ�ⳣ������ʽΪK= ![]() ��ÿ����1mol H2��Ҫ����131.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��ÿ����1mol H2��Ҫ����131.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��2���ڸ������£�����Ӧ�ٵ���ʼŨ�ȷֱ�Ϊ��c��CO��=0.6molL��1 �� c��H2��=1.4molL��1 �� 8min��ﵽƽ�⣬CO��ת����Ϊ50%����8min��H2��ƽ����Ӧ����Ϊ ��
��3����t��ʱ����Ӧ�ڵ�ƽ�ⳣ��Ϊ400�����¶��£���1L���ܱ������м���һ���ļ״�����Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
c��molL��1�� | 0.46 | 1.0 | 1.0 |
��ʱ��v��v�����������������=������ƽ��ʱc��CH3OCH3�������ʵ���Ũ���� ��
��4���ڣ�1��С���д���Ӧ�ҵ��ܷ�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g����CO��ƽ��ת����a��CO�����¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��ͼ��X��������¶ȡ���ѹǿ�����жϵ������� 
��5���ڴ�����������ͬʱ����������Ӧ������������ʼͶ�ϱ� ![]() �ĸı䣬�����Ѻͼ״��IJ��ʣ������е�̼ԭ��ռ��ʼCO��̼ԭ�ӵİٷ��ʣ�������ͼ2�ı仯���ƣ��Խ��Ͷ����Ѳ��ʺͼ״����ʱ仯��ԭ��
�ĸı䣬�����Ѻͼ״��IJ��ʣ������е�̼ԭ��ռ��ʼCO��̼ԭ�ӵİٷ��ʣ�������ͼ2�ı仯���ƣ��Խ��Ͷ����Ѳ��ʺͼ״����ʱ仯��ԭ��



