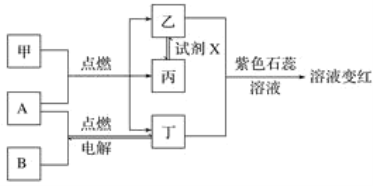
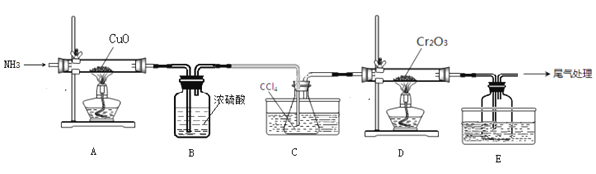
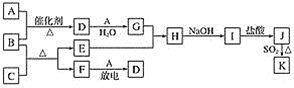
题目内容
【题目】氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知32 g甲醇燃烧生成二氧化碳和液态水放出的热量为725. 76 kJ,若上述过程生成的水为气态,则放出的热量________(填“大于”“小于”或“等于”) 725.76kJ。
(2)生产甲醇的原料 CO 和 H2来源于CH4(g)+H2O (g)CO(g)+3H2(g)△H > 0,100℃时,将1 mol CH4和2 mol H2O通入容积为1L的定容密封容器中,发生上述反应。
①能说明该反应已达到平衡状态的是________(填字母代号)。
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4的同时生成0.3mol H2
c.容器内的压强恒定
d.3v正(CH4) = v 逆(H2)
②如果反应开始至 5 min 后达到平衡 ,且平衡时CH4 的转化率为 50%,则从开始到平衡这段时间内用比表示的反应速率为___________。
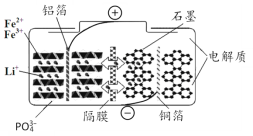
(3)近几年开发的甲醇燃料电池采用作铂电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理示意图如图所示:

①P t (a)电极是电池的________极,电极反应式为_____________ 。
②如果该电池工作时电路中通过1.806×1023个电子,则消耗 CH3OH___g。
【答案】小于 cd 0. 3molL-1 min-1 负 CH3OH-6e-+H2O=CO2 +6H+ 1.6
【解析】
气态水的能量高于液态水的能量;当正逆反应速率相等,各组分浓度不再改变的时反应达到平衡状态;根据燃料电池的工作原理示意图可知,甲醇生成二氧化碳,碳元素化合价升高,发生氧化反应,故P t (a)为负极。
(1)因为气态水所具有的能量高于液态水具有的能量,故甲醇燃烧生成气态水时放出的热量小于生成液态水时放出的能量。
(2)a.反应物和生成物均为气体,故反应前后气体的质量不变,容器的体积也一直不变,故容器内气体密度一直为恒定值,故不能说明达到平衡状态,a错误;
b.消耗CH4为反应正方向,生成 H2也反应正方向,不能说明正逆反应速率相等,故不能说明达到平衡状态,b错误;
c.根据反应方程式可知,该反应为反应前后气体分子数增大的反应,故反应开始容器内的压强增大,当压强恒定时说明反应达到平衡状态,c正确;
d.根据反应方程式可知,甲烷与氢气的化学计量数比为1:3,故反应速率之比也为1:3,故3v正(CH4) = v 逆(H2)说明正逆反应速率相等,反应达到平衡状态,d正确;
答案选cd。
②如果反应开始至 5 min 后达到平衡 ,且平衡时CH4 的转化率为 50%,故反应消耗的CH4的物质的量为0.5mol,生成的H2的物质的量为1.5mol,则从开始到平衡这段时间内用H2表示的反应速率v=![]() 。
。
(3)①综上分析,P t (a)电极是电池的负极,碳元素由-2价变为+4价,失去电子生成二氧化碳和氢离子,故电极反应式为CH3OH-6e-+H2O=CO2 +6H+。
②根据负极电极反应式可知,消耗1mol CH3OH转移6mol e-,则如果该电池工作时电路中通过1.806×1023个电子,物质的量为0.3mol,则消耗 CH3OH的物质的量为0.05mol,质量为1.6g。