题目内容
(11分)
工业上制备金属铝通常是用石墨作电极电解熔融的Al2O3。为使电解能顺利进行,常在熔融的Al2O3中加入冰晶石(Na3AlF6),并不断补充石墨电极。
1.写出阳极、阴极和电解池的反应。(4分)
2.加入冰晶石的主要作用是 ,
补充石墨电极的原因是 。(每空1分)
3.设电解池电流效率η=80%,电解电流为80A,要获得0.10kg Al需电解多长时间?(5分)
1.(4分)
阳极:Al2O3→2Al3++![]() O2+6e- 阴极:2Al3++6e-→2Al
O2+6e- 阴极:2Al3++6e-→2Al
电解池:Al2O3→2Al+![]() O2
O2
2. 降低熔液的熔点 石墨被电解产生的氧氧化而消耗 。(每空1分)
3. [解] 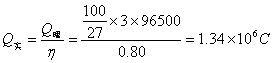
![]()

练习册系列答案
相关题目
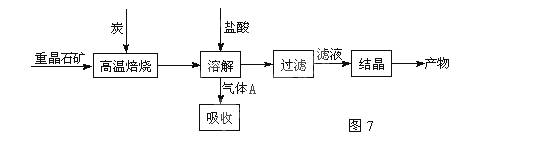
(11分)工业上制备BaCl2的工艺流程图如图7: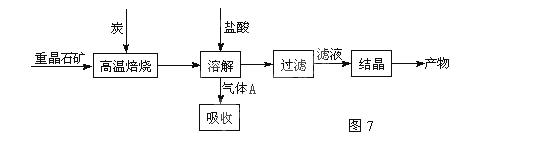
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。
已知:BaSO4(s) + 4C(s)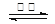 4CO(g) + BaS(s) △H1 =" +571.2" kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =" +571.2" kJ·mol-1 ①
BaSO4(s) + 2C(s)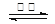 2CO2(g) + BaS(s) △H2=" +226.2" kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=" +226.2" kJ·mol-1 ②
(1)高温焙烧时常把原料粉碎,目的是_________________________________
(2)常温下,相同浓度的Na2S和NaHS溶液中,说法正确的是: (3分)
| A.Na2S溶液的pH比NaHS溶液pH大 |
| B.两溶液中含有的离子种类不同 |
| C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等 |
| D.两溶液中加入NaOH固体,c(S2-)都增大 |
(3)反应C(s) + CO2(g)
 2CO(g)的△H =
2CO(g)的△H = (4)制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为:
(5)实际生产中必须加入过量的炭,同时还要通入空气,目的是:
(写出一种原因即可)
 4CO(g) + BaS(s) △H1 =
+571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =
+571.2 kJ·mol-1 ①