题目内容
把4.6 g钠放入100 mL 0.1 mol·L-1AlCl3溶液中,待其充分反应后(水蒸发不计),下列叙述中错误的是( )
| A.Cl-浓度不变 | B.溶液仍有浑浊 |
| C.溶液中几乎不存在Al3+ | D.溶液中存在最多的是Na+ |
B
解析试题分析:4.6g钠的物质的量为4.6g/23g/mol =0.2mol,由反应2Na+2H2O=2NaOH+H2↑可知生成氢氧化钠0.2mol,AlCl3的物质的量为0.2L×0.1mol?L-1=0.02mol,n(Al3+):n(OH-)=0.02mol:0.2mol=1:10,Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,A、参加反应的水很小,溶液的体积变化不大,氯离子不反应,Cl-的浓度几乎不变,故A正确;B、Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,溶液澄清,故B错误;C、Al3+与OH-发生反应Al3++4OH-=AlO2-+2H2O,OH-有剩余,溶液中Al3+全部转化为AlO2-,故C正确;D、溶液中Na+为0.2mol,氯离子为0.06mol,偏铝酸根为0.02mol,氢氧根为0.2mol-0.02mol×4=0.12mol,故D正确。
考点:镁、铝的重要化合物;钠的化学性质。

有 MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中MgCl2、Al2(SO4)3的物质的量浓度之比为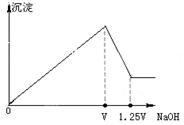
| A.1:1 | B.2:1 | C.3:2 | D.2:3 |
金属钠分别与下列溶液反应时,既有气体又有沉淀产生的是
| A.HCl | B.NaCl | C.FeCl3 | D.Na2SO4 |
下列方法不能用于鉴别Na2CO3和NaHCO3固体的是
| A.分别加热两种固体,将放出的气体通入澄清石灰水 |
| B.分别取两种固体溶于水,滴加Ba(OH)2溶液,观察是否生成沉淀 |
| C.分别取两种固体各 1 g,滴入几滴水振荡,用手触摸试管底部 |
| D.分别取等质量的固体与足量稀盐酸充分反应,加热、蒸干、灼烧称重 |
2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
| A.单质钠的密度比钾的密度小 |
| B.Na+和K+常用作氧化剂 |
| C.钠和钾都是短周期元素 |
| D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态 |
把镁粉中混有少量的铝粉除去,应选用的试剂是
| A.稀盐酸 | B.烧碱溶液 | C.硫酸铝溶液 | D.氨水 |
将Cu片放入0.1 mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中C(Fe3+):C(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为 ( )
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
取一小块钠,用滤纸去掉煤油,放在石棉网上加热,下列实验现象的描述正确的是 ①金属钠先熔化 ②在空气中燃烧呈苍白色火焰且火花四溅 ③燃烧后得到白色固体 ④燃烧时有黄色火焰 ⑤燃烧后生成淡黄色固体
| A.①②⑤ | B.①④⑤ | C.①②③ | D.①②④ |
为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是( )
| A.合金中镁的质量分数为63.3%≤Mg%<100% |
| B.该合金中含有铝的质量至少为5.4 g |
| C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2 |
| D.在产生沉淀后的溶液中有1.5 mol Na2SO4 |