题目内容
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于_______(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为_________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为___________,其所含化学键有__________,乙醇分子中C原子的杂化轨道类型为____________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(HSCN)、异硫氰酸(HNCS)两种。两者沸点:前者_____后者(填“高于”或“低于”)。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为________________。

(5)铜与金形成的金属互化物的晶胞结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为__________g·cm-3。(用含a、NA的代数式表示)
【答案】 晶体 1 1s22s22p63s23p63d9或[Ar]3d9 Cu(NH3)4SO4 共价键、离子键、配位键 sp3 5NA 低于 4 ![]()
【解析】(1)根据晶体和非晶体中微粒的排列特点分析;
(2)Cu为29号元素,电子排布式为1s22s22p63s23p63d104s1;配合物Cu(NH3)4SO4含化学键有共价键、离子键、配位键;乙醇分子中C原子成键电子对有4对,杂化轨道类型为sp3;
(3) (SCN)2分子结构式为N![]() C-S-S-C
C-S-S-C![]() N,1个N
N,1个N![]() C键中有1个
C键中有1个![]() 键,其余两个为
键,其余两个为![]() 键;分子间有氢键的能使物质熔沸点升高;
键;分子间有氢键的能使物质熔沸点升高;
(4)根据晶胞的结构图可求S2-的配位数;
(5)根据均摊法计算出晶胞中Cu、Au原子数,根据![]() 计算密度。
计算密度。
(1)晶体中粒子在三维空间里呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,因此,本题正确答案是:晶体;
(2)Cu为29号元素,电子排布式为1s22s22p63s23p63d104s1,可以看出只有4S轨道上的电子未成对,二价铜离子的电子排布式为1s22s22p63s23p63d9,在CuSO4溶液中滴入过量氨水,形成配合物为Cu(NH3)4SO4,所含化学键有共价键、离子键、配位键;乙醇分子中C原子成键电子对有4对,杂化轨道类型为sp3;
因此,本题正确答案是:1;1s22s22p63s23p63d9;共价键、离子键、配位键;sp3;
(3) (SCN)2分子结构式为N![]() C-S-S-C
C-S-S-C![]() N,1个N
N,1个N![]() C键中有1个
C键中有1个![]() 键,其余两个为
键,其余两个为![]() 键;1mol(SCN)2分子中含有
键;1mol(SCN)2分子中含有![]() 键的数目为5NA,异硫氰酸(H-N=C=S)分子中N原子上连接有H原子,分子间能形成氢键,故沸点高,即硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS),
键的数目为5NA,异硫氰酸(H-N=C=S)分子中N原子上连接有H原子,分子间能形成氢键,故沸点高,即硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS),
因此,本题正确答案是:5NA;低于;
(4)根据图1,距离S2-最近的锌离子有4个,即S2-的配位数为4,因此,本题正确答案是:4;
(5)Cu原子位于晶胞面心,数目为6×![]() =3,Au原子为晶胞顶点,数目为8×
=3,Au原子为晶胞顶点,数目为8×![]() =1,晶胞体积V=(a×10-7)3,密度
=1,晶胞体积V=(a×10-7)3,密度![]() =
=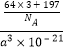 =
=![]() g/cm3=
g/cm3=![]() g/cm3,
g/cm3,
因此,本题正确答案是:![]() 。
。