题目内容
常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
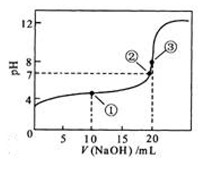
A.点①所示溶液中:
![]()
B.点②所示溶液中:
![]()
C.点③所示溶液中:
![]()
D.滴定过程中可能出现:
![]()
D
解析:
本题主要考查的是粒子浓度大小的比较。A项,处于点①时,酸过量,根据电荷守恒,则有c(H+)=c(OH-)+c(CH3COO-);B项,在点②时,pH=7,仍没有完全反应,算过量,c(Na+)<c(CH3COO-)+c(CH3COOH);C项,当V(NaOH)=20.00ml时,两者完全反应,此时由于CH3COO-的水解,溶液呈碱性,但水解程度是微弱的,c(Na+)>c(CH3COO-)>c(OH-)>c(H+);D项,在滴定过程中,当NaOH的量少时,不能完全中和醋酸,则有![]() 综上分析可知,本题选D项。
综上分析可知,本题选D项。

 精英口算卡系列答案
精英口算卡系列答案|
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是
| |
| [ ] | |
A. |
点①所示溶液中:c(H+)/c(OH-)=1012 |
B. |
点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) |
C. |
点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
D. |
点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1 |
常温下,用 0.10 mol·L-1 NaOH 溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示:
 | |||
 |
图1 图2
则滴定HC1溶液的曲线是 _▲ (填“图1”或“图2”),说明判断依据 ▲ 。a与b的关系是:a _▲ b(填“>”、“<”或“=”);E点对应离子浓度由大到小的顺序为 _▲ ;




