题目内容
(2009?金华模拟)有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
分析:还原性:I->Fe2+>Br->Cl-,根据点和守恒2n(Fe2+)=n(Cl-)+n(Br-)+n(I-)计算n(Fe2+),根据溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,计算消耗的氯气和剩余Fe2+的物质的量,可则解答该题.
解答:解:由题意可设Cl-、Br-、I-的物质的量分别为2mol、3mol、4mol,
由电荷守恒可得:2n(Fe2+)=n(Cl-)+n(Br-)+n(I-)=2mol+3mol+4mol=9mol,n(Fe2+)=4.5mol,通入氯气后,要满足 n(Cl-):n(Br-)=3:1,
Cl-只要增加7mol就可以,即需通入氯气3.5mol.4mol I-先消耗2mol氯气,3mol Fe2+消耗1.5mol氯气,
剩余Fe2+1.5mol,则通入氯气与剩余Fe2+的物质的量之比为:3.5:1.5=7:3,
故选B.
由电荷守恒可得:2n(Fe2+)=n(Cl-)+n(Br-)+n(I-)=2mol+3mol+4mol=9mol,n(Fe2+)=4.5mol,通入氯气后,要满足 n(Cl-):n(Br-)=3:1,
Cl-只要增加7mol就可以,即需通入氯气3.5mol.4mol I-先消耗2mol氯气,3mol Fe2+消耗1.5mol氯气,
剩余Fe2+1.5mol,则通入氯气与剩余Fe2+的物质的量之比为:3.5:1.5=7:3,
故选B.
点评:本题考查氧化还原反应的计算,题目难度中等,本题注意根据物质还原性的强弱,从电荷守恒的角度计算n(Fe2+),根据反应的程度判断物质的量关系,答题时注意体会.

练习册系列答案
相关题目
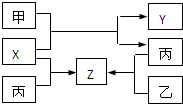 (2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系:
(2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系: