题目内容
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
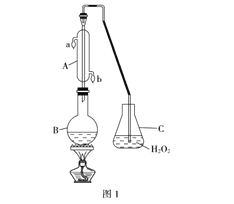
(1)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_______________________________________________________。
(2)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定。若滴定前俯视,滴定后仰视,对滴定结果的影响是____________(填无影响、偏高或偏低);若滴定前滴定管尖嘴有气泡,滴定后气泡消失,对滴定结果的影响是____________(填无影响、偏高或偏低);若滴定终点时溶液的pH=8.8,则选择的指示剂为___________________;滴定终点的判断为_____________________________________________。
(3)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:__________g·L-1。
(4)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________________________________。
【答案】SO2+H2O2=H2SO4偏高偏高酚酞滴最后一滴,溶液恰好由无色变浅红色,且30秒无变化0.24原因:盐酸易挥发;改进措施:用不挥发的强酸(如硫酸)代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响。
【解析】
(1)SO2具有还原性,H2O2具有强氧化性,H2O2把SO2氧化成H2SO4,反应方程式为H2O2+SO2=H2SO4;(2)滴定管的从上到下刻度增大,滴定前俯视,滴定后仰视,消耗的NaOH体积增大,测的SO2的量偏高;滴定前滴定管尖嘴有气泡,滴定后气泡消失,消耗的NaOH的体积增大,测的SO2量偏高;选择指示剂,滴定后溶液的pH与指示剂的变色范围应一致,pH=8.8溶液显碱性,酚酞的变色范围是8.2~10.0,因此应用酚酞作指示剂;滴最后一滴NaOH,溶液恰好由无色变浅红色,且30秒无变化;(3)根据过程,得出SO2~H2SO4~2NaOH,n(SO2)=25×10-3×0.09/2mol=1.125×10-3mol,其质量为1.125×10-3×64g=7.2×10-2g,则SO2的含量为7.2×10-2/300×10-3g·L-1=0.24g·L-1;(4)测定结果比实际值偏高,说明溶液中酸的量高,B装置中加入葡萄酒和盐酸,盐酸具有挥发性,加热时,进入装置C,消耗的NaOH的量增加;改进措施为用不挥发的强酸(如硫酸)代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】明代《天工开物》中记载:“属草木者为枲、麻、苘、葛,属禽兽与昆虫者裘褐、丝绵。”文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于
A.纤维素、油脂B.糖类、油脂C.纤维素、蛋白质D.油脂、蛋白质
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为__________。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D _____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:
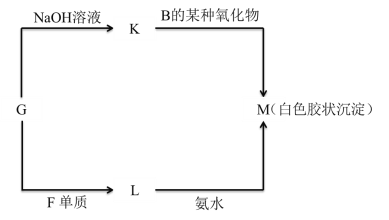
①写出 G 转化为 K 的化学方程式________________________________________。
②写出 L 转化为 M 的离子方程式________________________________________。

