题目内容
【题目】在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是![]()
A. 容器内压强不随时间变化
B. v正(X) =v逆(Z)
C. 容器内X、Y、Z的浓度之比为l:2:2
D. 单位时间内消耗0.1molX的同时生成0.2molZ
【答案】A
【解析】反应达到平衡的标志有速率标志,即正逆反应速率相等;“量”的标志,即浓度、n、含量、P等保持一定,结合反应方程式解析如下。
A、这是一个反应前后气体物质的量不等的反应,即压强会改变,所以当压强不随时间变化时说明反应已达平衡,故A正确;
B、v正(X) =v逆(Z),尽管体现了正逆两个方向的速率,但是速率数值之比不等于计量系数之比,说明正逆反应速率不相等,反应没有达到平衡状态,所以B错误;
C、平衡时容器内各物质的浓度之比与其开始时加入的量有关,所以浓度之比等于对应的计量系数之比,不能说明反应已达平衡状态,故C错误;
D、单位时间内消耗0.1molX,是正向速率,同时生成0.2molZ也是正向速率,同一方向的速率不能说明反应已达平衡状态,故D错误。本题答案为A。

 智慧小复习系列答案
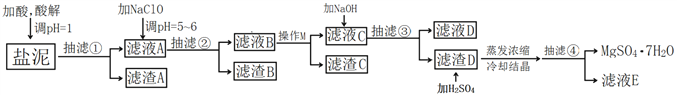
智慧小复习系列答案【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:
已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)
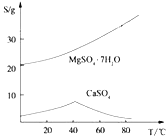
根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。