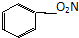
题目内容
短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
(1)X元素在元素周期表中的位置______.
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为______.
(3)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为______.
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器______(填“能”或“不能”)用来腌制咸菜,原因是______.
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式______.关于该电池的下列说法,正确的是______.
A.工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
□______+□MnO4-+□H+═□CO2+□Mn2++□H2O.

| X | Y | Z | |
| W |
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为______.
(3)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为______.
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器______(填“能”或“不能”)用来腌制咸菜,原因是______.
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式______.关于该电池的下列说法,正确的是______.
A.工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
□______+□MnO4-+□H+═□CO2+□Mn2++□H2O.

由短周期元素X、Y、Z、W在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,在同周期元素的常见简单离子中,W的简单离子半径最小,则W为Al,可推知X为C、Y为N、Z为O,
(1)X为C元素,原子核外有2个电子层、最外层电子数为4,处于周期表中第二周第ⅣA族,故答案为:第二周第ⅣA族;
(2)液态NH3与液态H2O可以发生类似方式电离,则液态NH3中电离得到NH4+、NH2-,NH2-中N原子与H原子之间形成1对共用电子对,其电子式为: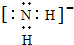 ,
,
故答案为: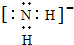 ;
;
(3)Al2O3、N2、C在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1,反应生成AlN与CO,反应方程式为:Al2O3+N2+3C
2AlN+3CO,
故答案为:Al2O3+N2+3C
2AlN+3CO;
(4)氯离子会破坏铝表面氧化膜,铝容器不能用来腌制咸菜,故答案为:氯离子会破坏铝表面氧化膜;
(5)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,
A.工作时电极b通入空气,b作正极,阴离子向负极移动,O2-由电极b流向电极a,故A正确;
B.原电池放电时电子从负极流向正极,故电流由电极b通过传感器流向电极a,故B错误;
C.一氧化碳的含量越大,原电池放电时产生的电流越大,故C正确,
故答案为:CO-2e-+O2-═CO2;AC;
(6)由元素C与元素O组成的某种阴离子具有还原性,能被酸性KMnO4氧化,该阴离子为C2O42-,反应中C元素化合价由+3升高为+4,共升高2价,Mn元素化合价由+7降低为+2,共降低5价,化合价升降最小公倍数为10,故C2O42-的系数为5,MnO4-的系数为2,由原子守恒可知:CO2的系数为10,Mn2+的系数为5,H2O为8,H+的系数为16,故配平后离子方程式为:5C2O42-+2MnO4-+16H+═10CO2+2Mn2++8H2O,
故答案为:C2O42-;5、2、16、10、2、8.
(1)X为C元素,原子核外有2个电子层、最外层电子数为4,处于周期表中第二周第ⅣA族,故答案为:第二周第ⅣA族;
(2)液态NH3与液态H2O可以发生类似方式电离,则液态NH3中电离得到NH4+、NH2-,NH2-中N原子与H原子之间形成1对共用电子对,其电子式为:
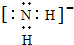 ,
,故答案为:
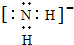 ;
;(3)Al2O3、N2、C在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1,反应生成AlN与CO,反应方程式为:Al2O3+N2+3C
| ||
故答案为:Al2O3+N2+3C
| ||
(4)氯离子会破坏铝表面氧化膜,铝容器不能用来腌制咸菜,故答案为:氯离子会破坏铝表面氧化膜;
(5)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为CO-2e-+O2-═CO2,
A.工作时电极b通入空气,b作正极,阴离子向负极移动,O2-由电极b流向电极a,故A正确;
B.原电池放电时电子从负极流向正极,故电流由电极b通过传感器流向电极a,故B错误;
C.一氧化碳的含量越大,原电池放电时产生的电流越大,故C正确,
故答案为:CO-2e-+O2-═CO2;AC;
(6)由元素C与元素O组成的某种阴离子具有还原性,能被酸性KMnO4氧化,该阴离子为C2O42-,反应中C元素化合价由+3升高为+4,共升高2价,Mn元素化合价由+7降低为+2,共降低5价,化合价升降最小公倍数为10,故C2O42-的系数为5,MnO4-的系数为2,由原子守恒可知:CO2的系数为10,Mn2+的系数为5,H2O为8,H+的系数为16,故配平后离子方程式为:5C2O42-+2MnO4-+16H+═10CO2+2Mn2++8H2O,
故答案为:C2O42-;5、2、16、10、2、8.

练习册系列答案
相关题目