题目内容
24mL 0.05 mol/L的Na2SO3溶液,恰好与20mL 0.02 mol/L的K2Cr2O7溶液完全反应,则Cr在还原产物中的化合价是
A.+6
B.+3
C.+2
D.0
B
解析:
![]()
摩尔失2 mol电子,设每molK2Cr2O7得n mol电子,则:
20×0.02×n=24×0.05×2 n=6
![]()

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)配制100 mL待测白醋溶液。量取10.00 mL市售白醋,注入烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得。
(2)用 量取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2
___________作指示剂。
(3)读取盛装0.100 0 mol·L-1 NaOH溶液的 (填仪器名称)的初始读数。如果液面位置下图所示,则此时的读数为 mL。
(4)滴定。滴定过程中,眼睛应观察 。滴定终点后记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
| 滴定次数 实验数据/mL |
1 |
2 |
3 |
4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=[(15.95+15.00+15.05+14.95)/4] mL=15.24mL。
指出他的计算的不合理之处:______________________________________。
按正确数据处理,可得c(市售白醋)=___________mol·L-1;市售白醋总酸量=_________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_______ (填写序号)。
a.未用标准NaOH溶液润洗滴定管
b.锥形瓶中加入待测白醋溶液后,再加少量水
c.锥形瓶在滴定时剧烈摇动,有少量液体溅出
d.滴定前锥形瓶用待测白醋溶液润洗
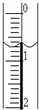 (2009?松江区二模)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
(2009?松江区二模)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).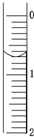 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).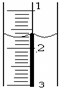 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).