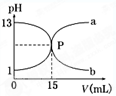
题目内容
某二元酸(化学式用H2A表示)在水中的电离方程式为:H2A====H++HA- HA-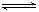 H++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( )
H++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( )
A.c(Na+)+ c(H+)= c(OH-)+ c(HA-)+ c(A2-)
B.c(Na+)+ c(OH-)= c(H+)+ c(HA-)
C.c(Na+)="2" c(A2-)+2 c(HA-)+2 c(H2A)
D.c(A2-) + c(HA-)="0.1" mol·L-1
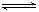 H++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( )
H++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( )A.c(Na+)+ c(H+)= c(OH-)+ c(HA-)+ c(A2-)
B.c(Na+)+ c(OH-)= c(H+)+ c(HA-)
C.c(Na+)="2" c(A2-)+2 c(HA-)+2 c(H2A)
D.c(A2-) + c(HA-)="0.1" mol·L-1
D
试题分析:A、B均不正确,不符合电荷守恒,应该是c(Na+)+ c(H+)= c(OH-)+ c(HA-)+ 2c(A2-);C不正确,溶液中不存在H2A分子;D正确,符合物料守恒,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,基础性强。侧重对学生能力的培养和基础知识的巩固与训练。该题的关键是利用好溶液中的几种守恒关系,另外还需要注意的是该酸的第一步电离是完全电离的。

练习册系列答案
相关题目
 、Cl-四种离子,且c(NH
、Cl-四种离子,且c(NH
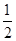 O2(g) = H2O(1)△H= ―285.8kJ/mol
O2(g) = H2O(1)△H= ―285.8kJ/mol