题目内容
反应4A(g) + 5B(g) 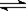 4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
A.若增大压强,A和B的转化率都增大
B.若升高温度最终能生成更多的C和D
C.单位时间里有4n mol A消耗,同时有5n mol B生成
D.容器里A、B、C、D的浓度比是4:5:4:6
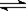 4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:A.若增大压强,A和B的转化率都增大
B.若升高温度最终能生成更多的C和D
C.单位时间里有4n mol A消耗,同时有5n mol B生成
D.容器里A、B、C、D的浓度比是4:5:4:6
C
该反应是体积增大的放热的可逆反应。增大压强,平衡向逆反应方向移动,A和B的转化率都减小,A不正确。升高温度平衡也向逆反应方向移动,不利于CD的生成,B不正确。平衡后单位时间里有4n mol A消耗,必然同时生成4n mol A,根据速率之比是化学计量数之比,同时也应该生成5n mol B,C正确。达到平衡后容器里A、B、C、D的浓度比不一定是4:5:4:6 ,D不正确。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
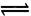 I3一(aq)。测得不同温度下该反应的平衡常数值如下表:
I3一(aq)。测得不同温度下该反应的平衡常数值如下表: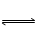 I3-(aq)的△H>0
I3-(aq)的△H>0  B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol、4 mol。在保持温度和压强不变的条件下,下列说法正确的是
B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol、4 mol。在保持温度和压强不变的条件下,下列说法正确的是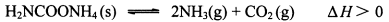 ,下列说法正确的是()
,下列说法正确的是() CO2(g) + H2(g), 在密闭容器达到平衡。 当温度为749K时,K= 1,当CO的起始浓度仍为2 mol·L-1, H2O的起始浓度为6mol·L-1时,则CO的转化率为( )
CO2(g) + H2(g), 在密闭容器达到平衡。 当温度为749K时,K= 1,当CO的起始浓度仍为2 mol·L-1, H2O的起始浓度为6mol·L-1时,则CO的转化率为( ) 2C(g) + D(g) △H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
2C(g) + D(g) △H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是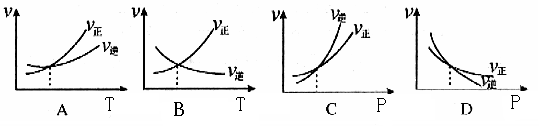
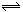 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )