题目内容
已建立化学平衡的某可逆反应,改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是( )
| A.此时正反应速率一定大于逆反应速率 | B.反应一定放出热量 |
| C.平衡时反应物的浓度一定降低 | D.平衡时生成物的质量分数一定增加 |
A
试题分析:根据平衡移动的原理可知,如果化学平衡向正反应方向移动,则正反应速率一定大于逆反应速率,A正确。但选项B、C、D都是不一定的,答案选A。
点评:可逆反应达到平衡状态的实质是正逆反应速率相等,一旦正逆反应速率不再相等,则平衡状态被平衡,需要重新建立新的平衡状态。所以如果正反应速率大于逆反应速率,则平衡一定向正反应方向移动,反之向逆反应方向移动。但由于引起反应速率变化的外界条件又多种情况,因此物质的浓度、含量等的变化需要具体问题具体分析,而不能生搬硬套。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是
H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是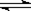 ?CH3OH(g)。
?CH3OH(g)。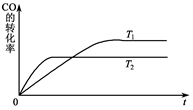
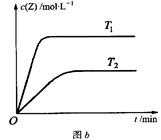
 Z(g)(未配平)。温度为T0时,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平)。温度为T0时,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是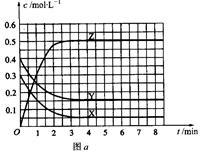
 (g)+1/2O
(g)+1/2O SO
SO (g)△H=-98.32kJ/mol,现有4molSO
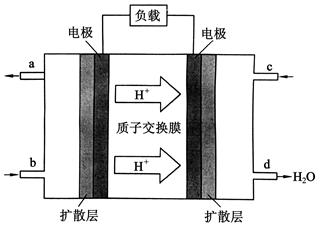
(g)△H=-98.32kJ/mol,现有4molSO 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题: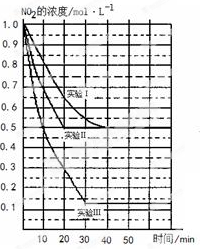
 _________(填“正向移动”或“逆向移动”或“不移动”)
_________(填“正向移动”或“逆向移动”或“不移动”) SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比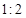 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是 2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白: