题目内容
2.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:(1)用元素符号表示D所在周期(除稀有气体元素外)电负性最大的元素是F.
(2)已知元素周期表可按电子排布分为s区、p区等,则E元素在d区.
(3)画出D的核外电子排布图
 .
.(4)C元素的氢化物分子中C原子的杂化方式为sp3;B元素与氯元素形成的晶体中,阴离子的配位数为6,影响该晶体稳定性的数据(物理量)是晶格能.
分析 A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,据此解答.
解答 解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
(1)D是N元素,处于第二周期,同周期自左而右电负性增大,故第二周期中F元素电负性最大,故答案为:F;
(2)E为Fe元素,E的核外电子排布式为1s22s22p63s23p63d64s2,Fe在周期表中处于第四周期第Ⅷ族,在周期表中处于d 区,
故答案为:d;
(3)D是N元素,原子核外有7个电子,其核外电子排布图为: ,
,
故答案为: ;
;
(4)C的氢化物为PH3,P原子形成3个P-H键,含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,B元素与氯元素形成的晶体为NaCl,阴离子的配位数为6,属于离子晶体,影响该晶体稳定性的数据(物理量)是晶格能,
故答案为:sp3;6;晶格能.
点评 本题考查元素推断、元素周期律、核外电子排布规律、杂化方式、离子晶体等,难度不大,推断元素是解题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 上述四种元素的原子半径大小为W<X<Y | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | 由W和Y元素组成的化合物不止一种 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| A. | 化合价的升降 | B. | 离子定向移动 | C. | 氧化还原反应 | D. | 电能的储存 |
| A. | 二氧化硫和二氧化碳都能使澄清的石灰水变浑浊 | |
| B. | 二氧化硫通入BaCl2溶液中生成BaSO3白色沉淀 | |
| C. | 二氧化硫通入滴有酚酞的NaOH溶液中,红色褪去,说明二氧化硫具有漂白性 | |
| D. | 硫在过量的氧气中燃烧生成三氧化硫 |
| A. | 次氯酸的结构式为H-Cl-O | B. | 丁烷的结构简式为CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式为 | D. | 苯的分子式为 |
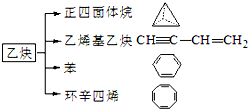 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: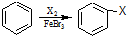 ).
). .
.

 的分子式为:C8H18,其一氯代物有4种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:(CH3)3CC(CH3)3
的分子式为:C8H18,其一氯代物有4种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:(CH3)3CC(CH3)3 .
.