题目内容
将78 g金属钾在空气中燃烧,生成KO2和K2O2的混合物。该混合物与足量的CO2充分反应后生成O2(4KO2+2CO2→2K2CO3+3O2),得到O2的物质的量可能为
| A.0.50 mol | B.0.75 mol | C.1.00 mol | D.1.50 mol |
BC
试题分析:78g钾的物质的量78g÷39g/mol=2mol,如果全部生成KO2,则KO2的物质的量是2mol。根据反应方程式4KO2+2CO2→2K2CO3+3O2可知,生成氧气的物质的量是1.5mol。如果全部生成K2O2,则K2O2的物质的量是1mol,则根据方程式2 K2O2+2CO2→2K2CO3+O2可知,生成氧气的物质的量是0.5mol,因此最终生成氧气的物质的量应该介于0.5mol和1.5mol之间,答案选BC。2反应的有关计算

练习册系列答案
相关题目
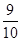 ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)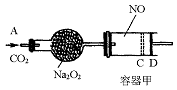
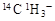 )所含的中子数和电子数分别为8NA、9NA
)所含的中子数和电子数分别为8NA、9NA