��Ŀ����
(10��)��һ�ݻ�Ϊ2 L���ܱ������У�����0.2 mol��N2��0.6 mol��H2����һ�������·�����Ӧ��N2(g)��3H2(g)  2NH3(g)����H��0
2NH3(g)����H��0
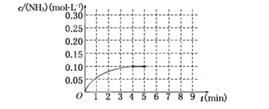
��Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺

(1)������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(NH3)Ϊ______________��
(2)�÷�Ӧ�ﵽƽ��ʱH2��ת����________��
(3)��Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ��ﵽ��ƽ��ʱNH3�����ʵ���Ũ�Ȳ�����Ϊ____________��(�����)
A��0.20 mol��L��1 b��0.12 mol��L��1 c��0.10 mol��L��1 d��0.08 mol��L��1
(4)�ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ��(��ʱNH3��Ũ��ԼΪ0.25 mol��L��1)��������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߣ�
��5�����������Ӧ����ͬ�¶Ⱥ������н��У���ʹ��Ӧ�ﵽƽ��ʱNH3�����ʵ���������ԭƽ����ȣ���ʼ������������ʵ����ʵ���n��N2����n��H2����n��NH3���ֱ�Ϊa��b��c����a��b��c֮��Ӧ������Ĺ�ϵʽΪ��
(6)���÷�Ӧ��298K��398Kʱ�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2����K1 K2������� ��=�� �� ������ ����
(1)0.025 mol/(L��min) (2)50% (3)a��c (4)������Ӧ����

��5��a+c/2=0.2 ��b+3c/2=0.6 ��6��>
����������1������ͼ����жϷ�Ӧ���е�4minʱ�ﵽƽ��״̬����ʱ������Ũ��0.10mol/L�������䷴Ӧ����Ϊ ��
��
��2����Ϊ���������ʵ�����0.1mol/L��2L��0.2mol�����ݷ���ʽ��֪������������0.3mol��������ת������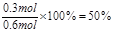 ��
��
��3��ƽ��ʱ�����������Ͱ�����Ũ�ȷֱ�Ϊ0.05mol/L��0.15mol/L��0.1mol/L����Ϊ��Ӧ�ǿ��淴Ӧ���������͵�����ȫת��Ϊ������������0.2mol/L����������Ũ��һ��С��0.2mol/L����Ϊ�ı��¶�ƽ��һ�������ƶ�����������Ũ�Ȳ�����������0.1mol/L����˴���a��c��
��4�������ݻ���С��ѹǿ����ƽ��������Ӧ�����ƶ���ƽ��ʱNH3Ũ�ȵı仯����Ϊ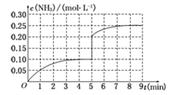
��5��Ҫ��������������������������͵��������ʵ�������ֱ�����0.6mol��0.2mol����a+c/2=0.2 ��b+3c/2=0.6��
��6����Ӧ�Ƿ��ȷ�Ӧ�����������¶�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С��

 �����ѣ�CH3OCH3����һ�ָ�Ч����࣬���������������ܵ�����ȼ�ϣ���ҵ���Ʊ�������ʱ�ڴ���Ӧ���У�ѹǿ2.0��10.0MPa���¶�230��280�棩���еķ�ӦΪ��
�����ѣ�CH3OCH3����һ�ָ�Ч����࣬���������������ܵ�����ȼ�ϣ���ҵ���Ʊ�������ʱ�ڴ���Ӧ���У�ѹǿ2.0��10.0MPa���¶�230��280�棩���еķ�ӦΪ��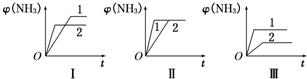
 2NH3(g)����H��0
2NH3(g)����H��0