题目内容
 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
(1)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
-246.1KJ/mol
-246.1KJ/mol
.(2)在温度和容积不变的条件下发生反应①,能说明该反应达到化学平衡状态的依据是
ab
ab
(多选扣分).a.容器中压强保持不变;b.混合气体中c(CO)不变;c.v正(CO)=v逆(H2);d.c(CH3OH)=c(CO)
(3)在2L的容器中加入amolCH3OH(g)发生反应②,达到平衡后若再加入amolCH3OH(g)重新达到平衡时,CH3OH的转化率
不变
不变
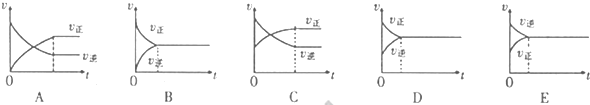
(填“增大”、“减小”或“不变”).(4)850℃时在一体积为10L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示.
①0~4min的平均反应速率υ(CO)=
0.03mol/L?min
0.03mol/L?min
.②若温度不变,向该容器中加入4molCO、2molH2O、3molCO2(g)和3molH2(g),起始时D正
<
<
V逆(填“<”、“>”或“=”),请结合必要的计算说明理由Qc=
=
,K=
=1,因为Qc>K,平衡左移,V正<V逆
| 0.3,mol/L×0,3mol/L |
| 0.4mol/L×0.2mol/L |
| 9 |
| 8 |
| 0.12mol/L×0.12mol/L |
| 0.08mol/L×0.18mol/L |
Qc=
=
,K=
=1,因为Qc>K,平衡左移,V正<V逆
.| 0.3,mol/L×0,3mol/L |
| 0.4mol/L×0.2mol/L |
| 9 |
| 8 |
| 0.12mol/L×0.12mol/L |
| 0.08mol/L×0.18mol/L |
分析:(1)依据盖斯定律结合热化学方程式计算得到;
(2)化学平衡的标志是正逆反应速率相同,各组分浓度不变,据此分析选项判断;
(3)②反应前后气体体积不变,增大压强平衡不变;
(4)①依据化学反应速率概念结合图象分析计算;
②依据图象分析计算平衡常数,结合浓度商和平衡常数比较分析判断平衡移动方向.
(2)化学平衡的标志是正逆反应速率相同,各组分浓度不变,据此分析选项判断;
(3)②反应前后气体体积不变,增大压强平衡不变;
(4)①依据化学反应速率概念结合图象分析计算;
②依据图象分析计算平衡常数,结合浓度商和平衡常数比较分析判断平衡移动方向.
解答:解:(1)①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
依据盖斯定律①×2+②+③:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
故答案为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
(2)CO(g)+2H2(g)?CH3OH(g),反应是气体体积减小的放热反应;
a.反应前后气体体积变化,容器中压强保持不变,证明反应达到平衡,故a正确;
b.平衡状态的标志是物质浓度 保持不变,混合气体中c(CO)不变说明反应达到平衡,故b正确;
c.依据化学方程式反应达到平衡时2v正(CO)=v逆(H2)证明反应达到平衡,故C错误;
d.反应过程中c(CH3OH)=c(CO)说明剩余一氧化碳和生成甲醇浓度相同,但不能证明正逆反应速率相同,故d错误;
故答案为:ab;
(3)在2L的容器中加入amolCH3OH(g)发生反应②,反应前后气体体积不变,达到平衡后若再加入amolCH3OH(g)相当于增大压强,平衡不变,CH3OH的转化率不变
故答案为:不变;
(4)①图象分析平衡后一氧化碳浓度变化为0.2mol/L-0.08mol/L=0.12mol/L;V(CO)=
=0.03mol/L?min;
故答案为:0.03mol/L?min;
②若温度不变,向该容器中加入4molCO、2molH2O、3molCO2(g)和3molH2(g),Qc=
=
,K=
=1
因为Qc>K,平衡左移,V正<V逆
故答案为:<;因为Qc>K,平衡左移,所以V正<V逆.
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
依据盖斯定律①×2+②+③:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
故答案为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
(2)CO(g)+2H2(g)?CH3OH(g),反应是气体体积减小的放热反应;
a.反应前后气体体积变化,容器中压强保持不变,证明反应达到平衡,故a正确;
b.平衡状态的标志是物质浓度 保持不变,混合气体中c(CO)不变说明反应达到平衡,故b正确;
c.依据化学方程式反应达到平衡时2v正(CO)=v逆(H2)证明反应达到平衡,故C错误;
d.反应过程中c(CH3OH)=c(CO)说明剩余一氧化碳和生成甲醇浓度相同,但不能证明正逆反应速率相同,故d错误;
故答案为:ab;
(3)在2L的容器中加入amolCH3OH(g)发生反应②,反应前后气体体积不变,达到平衡后若再加入amolCH3OH(g)相当于增大压强,平衡不变,CH3OH的转化率不变
故答案为:不变;
(4)①图象分析平衡后一氧化碳浓度变化为0.2mol/L-0.08mol/L=0.12mol/L;V(CO)=
| 0.12mol/L |
| 4min |
故答案为:0.03mol/L?min;
②若温度不变,向该容器中加入4molCO、2molH2O、3molCO2(g)和3molH2(g),Qc=
| 0.3,mol/L×0,3mol/L |
| 0.4mol/L×0.2mol/L |
| 9 |
| 8 |
| 0.12mol/L×0.12mol/L |
| 0.08mol/L×0.18mol/L |
因为Qc>K,平衡左移,V正<V逆
故答案为:<;因为Qc>K,平衡左移,所以V正<V逆.
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素的分析判断,平衡常数的计算应用,题目难度中等.

练习册系列答案
相关题目

 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 . CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。