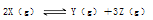题目内容
向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g)?Y(g)+3Z(g)
(1)经5min后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得的反应速率分别为:甲:ν(X)=3.5mol(L?min);乙:ν(Y)=2mol(L?min);丙:ν(Z)=4.5mol(L?min);丁:ν(X)=0.075mol(L?s).若其他条件相同,温度不同,温度由高到低的顺序是(填序号)
(3)若向达到(1)的平衡体系中充入氮气,则平衡向
(4)若在相同条件下向达到(1)所述平衡体系中再充入0.5molX气体,则平衡后X的转化率与(1)的平衡中X的转化率相比
A.无法确定 B.前者一定大于后者
C.前者一定等于后者 D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则a、b、c应满足的关系为
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则起始时维持化学反应向逆反应方向进行,则c的取值范围应为
(1)经5min后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为
0.03
0.03
mol(L?min).(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得的反应速率分别为:甲:ν(X)=3.5mol(L?min);乙:ν(Y)=2mol(L?min);丙:ν(Z)=4.5mol(L?min);丁:ν(X)=0.075mol(L?s).若其他条件相同,温度不同,温度由高到低的顺序是(填序号)
丁>乙>甲>丙
丁>乙>甲>丙
.(3)若向达到(1)的平衡体系中充入氮气,则平衡向
不
不
(填“左”“右”或“不”,下同)移动;若将达到(1)的平衡体系中移走部分混合气体,则平衡向右
右
移动.(4)若在相同条件下向达到(1)所述平衡体系中再充入0.5molX气体,则平衡后X的转化率与(1)的平衡中X的转化率相比
B
B
A.无法确定 B.前者一定大于后者
C.前者一定等于后者 D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则a、b、c应满足的关系为
c=3ba≥0
c=3ba≥0
.(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则起始时维持化学反应向逆反应方向进行,则c的取值范围应为
0.9<c≤4.5
0.9<c≤4.5
.分析:(1)根据化学反应速率公式v=
计算X的反应速率,根据方程式系数之比等于化学反应速率之比计算用Y表示的反应速率;
(2)根据温度对反应速率的影响:温度越高,反应速率越快,将不同物质表示的反应速率统一为用同一物质表示的反应速率;
(3)根据影响化学平衡移动的因素:温度、浓度、压强来回答判断移动方向;
(4)根据压强对化学平衡移动的影响来回答判断;
(5)根据等效平衡建立的条件以及极限转化思想来回答;
(6)根据等效平衡建立的条件以及极限转化思想来回答.
| △c |
| △t |
(2)根据温度对反应速率的影响:温度越高,反应速率越快,将不同物质表示的反应速率统一为用同一物质表示的反应速率;
(3)根据影响化学平衡移动的因素:温度、浓度、压强来回答判断移动方向;
(4)根据压强对化学平衡移动的影响来回答判断;
(5)根据等效平衡建立的条件以及极限转化思想来回答;
(6)根据等效平衡建立的条件以及极限转化思想来回答.
解答:解:(1)设X物质的量的变化量是x,则
2X(g)?Y(g)+3Z(g)
初始物质的量:3 0 0
变化物质的量:x 0.5x 1.5x
平衡物质的量:3-x 0.5x 1.5x
经5min后达平衡,此时容器内压强为起始时的1.2倍,即
=
,解得x=0.6mol,所以Y的物质的量变化量是0.3mol,表示的化学反应速率为:
=0.03mol/(L?min),故答案为:0.03mol/(L?min);
(2)将四个反应速率甲:ν(X)=3.5mol(L?min);乙:ν(Y)=2mol(L?min);丙:ν(Z)=4.5mol(L?min);丁:ν(X)=0.075mol(L?s),都统一到用X表示的反应速率值分别为甲:ν(X)=3.5mol(L?min);乙:ν(X)=4mol(L?min);丙:ν(X)=3mol(L?min);丁:ν(X)=4.5mol(L?min),所以化学反应速率是丁>乙>甲>丙,温度越高,化学反应速率越快,所以温度大小关系是:丁>乙>甲>丙,故答案为:丁>乙>甲>丙;
(3)若向达到(1)的平衡体系中充入氮气,不会改变各组分的浓度,所以平衡不会移动,若将达到(1)的平衡体系中移走部分混合气体,则体系压强会减小,所以平衡向着气体系数和增大的方向进行,即向着正方向进行,故答案为:不;右;
(4)若在相同条件下向达到(1)所述平衡体系中再充入0.5molX气体,则体系压强增大,新平衡相当于是在原平衡基础上增大压强,逆向移动建立的,所以平衡后X的转化率减小,故答案为:B;
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,根据极限转化结构以及等效的条件,需要等比即等效,即
2X(g)?Y(g)+3Z(g)
(1)的投料:3mol 0 0
等效投料:0 1.5mol 4.5mol,
现在投料:a b c
等效投料:0 0.5a+b 1.5a+c
所以
=
,解得c=3b,且a≥0,故答案为:c=3b,a≥0;
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则需要建立等同等效,将3molX转化为产物Z的
物质的量是4.5mol,所以c的最大值是4.5mol,(1)建立平衡时,z的物质的量是0.9mol,所以要维持化学反应向逆反应方向进行,需要c大于0.9mol,即0.9<c≤4.5,故答案为:0.9<c≤4.5.
2X(g)?Y(g)+3Z(g)
初始物质的量:3 0 0
变化物质的量:x 0.5x 1.5x
平衡物质的量:3-x 0.5x 1.5x
经5min后达平衡,此时容器内压强为起始时的1.2倍,即
| 3 |
| 3-x+0.5x+1.5x |
| 1 |
| 1.2 |
| ||
| 5min |
(2)将四个反应速率甲:ν(X)=3.5mol(L?min);乙:ν(Y)=2mol(L?min);丙:ν(Z)=4.5mol(L?min);丁:ν(X)=0.075mol(L?s),都统一到用X表示的反应速率值分别为甲:ν(X)=3.5mol(L?min);乙:ν(X)=4mol(L?min);丙:ν(X)=3mol(L?min);丁:ν(X)=4.5mol(L?min),所以化学反应速率是丁>乙>甲>丙,温度越高,化学反应速率越快,所以温度大小关系是:丁>乙>甲>丙,故答案为:丁>乙>甲>丙;
(3)若向达到(1)的平衡体系中充入氮气,不会改变各组分的浓度,所以平衡不会移动,若将达到(1)的平衡体系中移走部分混合气体,则体系压强会减小,所以平衡向着气体系数和增大的方向进行,即向着正方向进行,故答案为:不;右;
(4)若在相同条件下向达到(1)所述平衡体系中再充入0.5molX气体,则体系压强增大,新平衡相当于是在原平衡基础上增大压强,逆向移动建立的,所以平衡后X的转化率减小,故答案为:B;
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,根据极限转化结构以及等效的条件,需要等比即等效,即
2X(g)?Y(g)+3Z(g)
(1)的投料:3mol 0 0
等效投料:0 1.5mol 4.5mol,
现在投料:a b c
等效投料:0 0.5a+b 1.5a+c
所以
| b+0.5a |
| 1.5a+c |
| 1 |
| 3 |
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则需要建立等同等效,将3molX转化为产物Z的
物质的量是4.5mol,所以c的最大值是4.5mol,(1)建立平衡时,z的物质的量是0.9mol,所以要维持化学反应向逆反应方向进行,需要c大于0.9mol,即0.9<c≤4.5,故答案为:0.9<c≤4.5.
点评:本题考查学生化学平衡的计算以及等效平衡的建立知识,属于综合知识的考查,综合性强,难度大.

练习册系列答案
相关题目
 Y(g)+3Z(g)
Y(g)+3Z(g)