题目内容
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并______________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
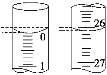
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL,所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
【答案】(1)锥形瓶中溶液颜色变化 在半分钟内不变色(2分)
(2)D (2分)
(3)0.00 26.10 26.10(3分)
(4)![]() =
=![]() =26.10 mL,
=26.10 mL,
c(NaOH)=![]() =0.104 4 mol·L-1(3分)
=0.104 4 mol·L-1(3分)
【解析】在求c(NaOH)和进行误差分析时应依据公式:c(NaOH)=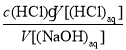 。欲求c(NaOH),须先求V[(HCl)aq]再代入公式;进行误差分析时,要考虑实际操作对每一个量即V[(HCl)aq]和V[(NaOH)aq]的影响,进而影响c(NaOH)。
。欲求c(NaOH),须先求V[(HCl)aq]再代入公式;进行误差分析时,要考虑实际操作对每一个量即V[(HCl)aq]和V[(NaOH)aq]的影响,进而影响c(NaOH)。
(1)考查酸碱中和滴定实验的规范操作。

(2)考查由于不正确操作引起的误差分析。滴定管未用标准盐酸润洗,内壁附着一层水,可将加入的盐酸稀释,消耗相同量的碱,所需盐酸的体积偏大,结果偏高;用碱式滴定管取出的待测NaOH溶液的物质的量一旦确定,倒入锥形瓶后,水的加入不影响OH-的物质的量,也就不影响结果;若排出气泡,液面会下降,故读取V酸偏大,结果偏高;正确读数(虚线部分)和错误读数(实线部分)如图所示。
(3)读数时,以凹液面的最低点为基准。
(4)先算出耗用标准酸液的平均值
![]() =
=![]() =26.10 mL (第二次偏差太大,舍去)。
=26.10 mL (第二次偏差太大,舍去)。
c(NaOH)=![]() =0.104 4 mol·L-1。
=0.104 4 mol·L-1。

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为________;
(2)Z的单质与水反应的化学方程式是____________________________;R与Q两元素最高价氧化物水化物反应的离子方程式______________________________;
(3)Y与R相比,非金属性较强的是___________(用元素符号表示),下列事实能证明这一结论的是________________(填字母序号);
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式__________________________;
(5)反应3X2(g)+P2(g)=2PX3(g)过程中的能量变化如图所示,回答下列问题。

①该反应是______反应(填“吸热”“放热”);该反应的△H=_______________;
②反应体系中加入催化剂对反应热是否有影响?__________(填“是”或“否”)。
【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。


熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是___________________,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时。
(2)B装置的冷凝管的主要作用是_____________,可否换为球形冷凝管(填“可”或“否”)。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为_______________(填装置字母代号)。
(4)A中Na2CO3的作用是____________________;D装置的作用是___________________
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出