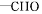题目内容
 常温下,A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,B、C、D都是含A元素的化合物,转化关系如图所示.
常温下,A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,B、C、D都是含A元素的化合物,转化关系如图所示.
(1)分别写出A、B、C、D的化学式:
A______; B______.
C______; D______.
(2)写出B的电离方程式:______.
(3)写出下列反应的离子方程式
A→B______.
D→A______.
解:A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,应为Cl2,和水反应生成B易分解,应为HClO,D为HCl,由转化关系可知C为NaCl,
(1)由以上分析可知A为Cl2,B为HClO,C为NaCl,D为HCl,故答案为:Cl2;HClO;NaCl;HCl;
(2)HClO为弱酸,部分电离,电离方程式为HClO?H++ClO-,故答案为:HClO?H++ClO-;
(3)氯气和水反应生成盐酸和次氯酸,反应的离子方程式为Cl2+H2O?H++Cl-+HClO,浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯气,反应的离子方程式为
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
故答案为:Cl2+H2O?H++Cl-+HClO;MnO2+4H++2Cl- Mn2++Cl2↑+2H2O.
Mn2++Cl2↑+2H2O.
分析:A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,应为Cl2,和水反应生成B易分解,应为HClO,D为HCl,由转化关系可知C为NaCl,结合对应物质的性质解答该题.
点评:本题考查无机物的推断,题目侧重于物质的性质的考查,注意以A为解答该题的突破口.
(1)由以上分析可知A为Cl2,B为HClO,C为NaCl,D为HCl,故答案为:Cl2;HClO;NaCl;HCl;
(2)HClO为弱酸,部分电离,电离方程式为HClO?H++ClO-,故答案为:HClO?H++ClO-;
(3)氯气和水反应生成盐酸和次氯酸,反应的离子方程式为Cl2+H2O?H++Cl-+HClO,浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯气,反应的离子方程式为
MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,故答案为:Cl2+H2O?H++Cl-+HClO;MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O.
Mn2++Cl2↑+2H2O.分析:A是双原子分子气态单质,A元素原子的最外层电子数比次外层电子数少一个,应为Cl2,和水反应生成B易分解,应为HClO,D为HCl,由转化关系可知C为NaCl,结合对应物质的性质解答该题.
点评:本题考查无机物的推断,题目侧重于物质的性质的考查,注意以A为解答该题的突破口.

练习册系列答案
相关题目
考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
(A)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是
。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |


 G+Zn(OH)Br
G+Zn(OH)Br A +2M (其中,F、G、M分别代表一种有机物)
A +2M (其中,F、G、M分别代表一种有机物)