题目内容
【题目】已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O![]() Fe2O3 + SO2↑+SO3↑+14H2O↑;以下装置可用来检验上述反应中所有的气体产物,回答问题:
Fe2O3 + SO2↑+SO3↑+14H2O↑;以下装置可用来检验上述反应中所有的气体产物,回答问题:
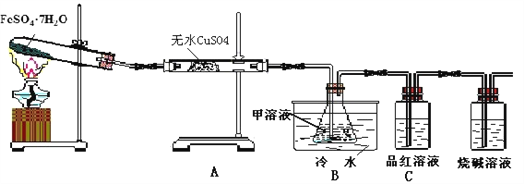
(1)用于检验SO2气体的装置是______(填装置的字母),确认水蒸气存在的现象是__________;
(2)利用装置B可以确认的产物是___________,装置B中的甲溶液可选(填序号)_____________,
①足量澄清石灰水 ②足量氯化钡溶液 ③足量硝酸钡溶液
该装置中冷水的作用是______________________;
(3)取试管中少许固体溶于适量盐酸中制备饱和铁盐溶液,将此饱和溶液逐滴加入沸水中加热片刻,观察液体的颜色变为______,检验该分散系的操作及现象为__________________。
【答案】 C 无水CuSO4白色粉末变为蓝色 SO3 ② SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收 红褐色液体 用一束光照射,若出现一条明显的光路,则证明该分散系为胶体
【解析】试题分析:(1)二氧化硫能使品红溶液褪色,因而检验二氧化硫通常红品红溶液,无水无水CuSO4白色粉末与水反应得到蓝色CuSO45H2O,因而常用无水CuSO4白色粉末检验水蒸汽,故答案为:C;无水CuSO4白色粉末变为蓝色;
(2)实验装置A中无水硫酸铜检验产无水,装置C品红溶液检验SO2,那么装置B中甲溶液肯定用于检验SO3;SO3溶于水生成硫酸,硫酸根离子和钡离子反应产生白色硫酸钡沉淀,由于硝酸具有强氧化性,可以吸收SO2妨碍SO2验证,因而不选足量硝酸钡溶液;SO3与水反应放出大量热,形成酸雾影响SO3的吸收,降低温度可降低酸雾的影响,故答案为:SO3;②;SO3与H2O的反应是放热反应,降低温度有利于SO3被水吸收;
(3)制备氢氧化铁胶体的方法是将有铁离子的饱和溶液逐滴加入沸水中加热直至液体呈现红褐色,得到的氢氧化铁胶体为红褐色,利用丁达尔效应是检验胶体的最简单方法,用一束光照射,若出现一条明显的“光路”即为丁达尔现象,故答案为:红褐色液体;用一束光照射,若出现一条明显的光路,则证明该分散系为胶体。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D