题目内容
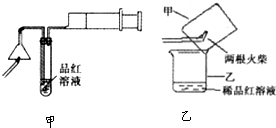
某研究性学习小组为研究铜与浓硫酸的反应,设计了如下图所示的实验探究方案(装置中的固定仪器和酒精灯均未画出)。
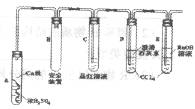
以下是该学习小组部分交流记录及后续探究实验的记录。
实验1:加热后,液面下铜丝变黑,产生气泡,一段时间后液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色硫固体凝聚,持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化,将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3:将浓硫酸液面下方铜丝的黑色物质刮下后,经稀硫酸洗、蒸馏水洗、过滤、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量比加热前减少。
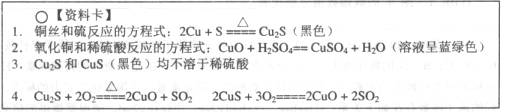
【问题探究】
(1)A试管上方的长导管的作用是______;D、E两试管中CCl4的作用是________。
(2)写出淡黄色固体物质消失的化学方程式_________________________________。
(3)试管D中的澄清石灰水变浑浊后又变澄清,变澄清的原因是(用方程式表示)________
(4)根据上述研究,结合资料卡上的内容,你认为液面下方铜丝表面的黑色物质成分肯定有___________________________
(1)冷凝、回流,防止倒吸
(2)S+2H2SO4(浓)=3SO2↑+2H2O
(3)CaSO3+SO2+H2O=Ca(HSO3)2
(4)CuO、CuS

练习册系列答案
相关题目
某研究性学习小组根据侯德榜制碱法原理并参考下表有关物质溶解度(g/100g水)数据,以饱和NaCl溶液与研细的NH4HCO3为原料,设计实验经两步反应制备纯碱.
下列有关说法中,正确的是( )
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 35℃以上分解 | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| A、第一、二步反应的基本类型为化合反应、分解反应 |
| B、第一、二步反应之间的主要实验操作是过滤、洗涤 |
| C、第一步反应控制温度高于30℃目的是提高反应产率 |
| D、反应液加盐酸处理可使NaCl循环使用并回收NH4Cl |
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.