题目内容
下列变化过程不必利用催化剂的是( )
| A、NH3+O2→NO | B、CH4→CH3Cl | C、C6H6+H2→C6H12 | D、C6H12O6→C2H5OH |
分析:A.NH3+O2→NO,反应条件是催化剂、加热;
B.CH4→CH3Cl,反应条件是光照;
C.C6H6+H2→C6H12,反应条件是催化剂、加热;
D.C6H12O6→C2H5OH,反应条件是催化剂.
B.CH4→CH3Cl,反应条件是光照;
C.C6H6+H2→C6H12,反应条件是催化剂、加热;
D.C6H12O6→C2H5OH,反应条件是催化剂.
解答:解:A.NH3+O2→NO,反应条件是催化剂、加热,故A错误;
B.CH4→CH3Cl,反应条件是光照,故B正确;
C.C6H6+H2→C6H12,反应条件是催化剂、加热,故C错误;
D.C6H12O6→C2H5OH,反应条件是催化剂,故D错误,
故选B.
B.CH4→CH3Cl,反应条件是光照,故B正确;
C.C6H6+H2→C6H12,反应条件是催化剂、加热,故C错误;
D.C6H12O6→C2H5OH,反应条件是催化剂,故D错误,
故选B.
点评:本题考查反应所需的条件,难度不大.要牢记常见反应的反应条件.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为______.利用反应6NO2(g)+8NH3(g)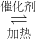 7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
(2)汽车尾气中含有NO和CO气体,对环境有影响.已知平衡常数K的值大小,是衡量化学反应进行程度的标志.在25℃时,下列反应及平衡常数如下
2NO(g)?N2(g)+O2(g)-Q1 K1=1×1030
2CO(g)+O2(g)?2CO2(g)+Q2 K2=2.5×1091
为了完成汽车尾气处理装置的改造,除去氮氧化物、一氧化碳污染气体,根据上述有关数据判断,下列说法正确的是______
A.改造后的尾气装置使用高温高压,可大量减少污染气体的排放
B.汽车尾气中氮氧化物在空气中会自动的转化为氮肥,对植物生长有益,可不必除去
C.改造后的尾气装置使用催化剂,可大量减少污染气体的排放
D.根据K1和K2的数据,尾气中NO和CO可自行转化为无害气体
(3)一定条件下将CO和H2O发生反应,可减少CO对环境的影响.若在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1<t2):
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
(4)酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
现有含CaO杂质的CaC2试样.某研究性学习小组的同学在实验室拟用以下两种方案测定CaC2试样的纯度.请填写下列空白:
第一种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数.先称取试样1.60g,锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
| 读数次数 | 质量/g | |
| 第1次 | 196.30 | |
| 第2次 | 196.15 | |
| 锥形瓶十水十试样 | 第3次 | 196.05 |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |
(2)测量数据不断减小的原因是______.不必作第6次读数的理由是______.
(3)利用以上数据计算CaC2试样的纯度______(请保留3位有效数字)
第二种方案:称取一定质量的试样ag,操作流程如下:

(4)在烧杯中溶解试样时,用盐酸而不用硫酸的主要原因是______.
(5)操作Ⅰ的名称是______.操作Ⅰ的主要仪器(夹持仪器和加热仪器除外)______.操作Ⅰ后应将样品放在______中冷却后进行称量.最后冷却称量的物质成分是______.
(6)如果在转移溶液时不发生液体外溅,你认为要保证溶液转移完全还必须进行的操作是______.
