题目内容
(6分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学 化学知识回答下列问题:
化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序___。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)浓度为0.1mol/L的(NH4)2Fe(SO4)2溶液与(1)相比c(NH4+) 中的大(填化学式)
 化学知识回答下列问题:
化学知识回答下列问题:(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序___。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)浓度为0.1mol/L的(NH4)2Fe(SO4)2溶液与(1)相比c(NH4+) 中的大(填化学式)
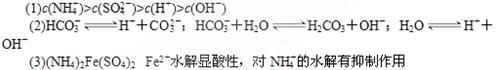
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 (偏高、偏低或无影响)。
(偏高、偏低或无影响)。 管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
 g(OH)2沉淀,说明MgCO3的溶解度小于Mg(OH)2
g(OH)2沉淀,说明MgCO3的溶解度小于Mg(OH)2 烧杯中滴加FeCl3饱和溶液并长时间煮沸
烧杯中滴加FeCl3饱和溶液并长时间煮沸