题目内容
11.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验.I、甲同学向1mol•L-1氯化铁溶液中加入少量的NaOH溶液;II、乙同学直接加热饱和FeCl3溶液;III、丙同学向25ml沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热.
试回答下列问题:
(1)其中操作正确的同学是丙同学.
(2)证明有Fe(OH)3胶体生成的最简单的实验操作是用激光笔照射溶液,若出现明显的光路,则说明有Fe(OH)3胶体生成.
(3)生成Fe(OH)3胶体的化学方程式:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl
(4)向丁同学利用所制得的Fe(OH)3胶体其中逐滴加入H2SO4溶液,产生的现象是:首先生成红褐色沉淀;然后红褐色沉淀逐渐溶解,最后形成黄褐色溶液.
分析 (1)制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热;
(2)只有胶体具有丁达尔效应,可以验证胶体的产生;
(3)氯化铁水解生成氢氧化铁胶体;
(4)根据胶体的性质判断,加入稀硫酸产生聚沉现象,氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,硫酸和氢氧化铁沉淀反应,生成硫酸铁和水.
解答 解:(1)甲同学向1mol•L-氯化铁溶液中加入少量的NaOH溶液,会发生复分解反应生成红褐色沉淀,乙同学直接加热饱和FeCl3溶液,三价铁会水解生成红褐色沉淀,制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,故答案为:丙同学;
(2)胶体具有丁达尔效应:当光束通过胶体时,从侧面观察到一条光亮的“通路”,故答案为:用激光笔照射溶液,若出现明显的光路,则说明有Fe(OH)3胶体生成;
(3)氯化铁水解生成氢氧化铁胶体,化学方程式:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;
(4)电解质H2SO4电离出的SO42-使Fe(OH)3胶体发生聚沉,生成红褐色沉淀,继续加入硫酸,会发生酸碱中和反应,生成氯化铁和水,故答案为:生成红褐色沉淀;红褐色沉淀逐渐溶解,最后形成黄褐色溶液.
点评 本题考查Fe(OH)3胶体的制备知识,注意氢氧化铁胶体的聚沉以及沉淀的溶解原因是解答本题的关键,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
1.按等物质的量混合的下列气体,碳元素的质量分数最大的是( )
| A. | 甲烷和乙烷 | B. | 乙炔和丙烯 | C. | 乙烷和乙烯 | D. | 丁炔和乙烯 |
19.下列可逆反应中,正反应是吸热反应的是( )
| A. | PCl3(l)+Cl2(g)?PCl5(s) 降温,PCl3转化率增大 | |
| B. | NO2(g)+SO2(g)?NO(g)+SO3(g) 降温,SO3的体积分数增加 | |
| C. | 2NO2(g)?2NO(g)+O2(g) 降温,颜色加深 | |
| D. | CS2(l)+2H2O(g)?CO2(g)+2H2S(g) 升温,CO2的平衡浓度增大 |
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,5.6L CCl4含有的分子数为0.25 NA | |
| C. | 在标准状况下,2.8g N2和2.24LCO所含质子数均为1.4NA | |
| D. | 常温下,1 L pH=1的硫酸溶液中含有的H+数为0.05NA |
3.已知:在同一反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.在一定条件下KClO3与I2按下式反应:2KClO3+I2═2KIO3+Cl2,下列判断正确的是( )
| A. | 该反应属于置换反应 | B. | 还原剂为KClO3,氧化剂为I2 | ||
| C. | 还原性:I2>KIO3 | D. | 氧化性:KClO3>KIO3 |
5.下列属于同位素的一组是( )
| A. | O2、O3 | B. | H2O、D2O | C. | H、D | D. | 1944K、2040Ca |
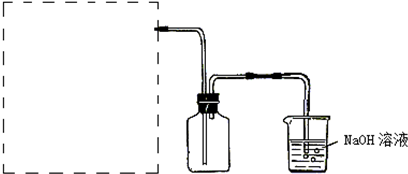
6.利用右图实验装置,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 |  | |
| A | 浓醋酸 | CaCO3 | Ca(ClO)2 | 酸性:醋酸>碳酸>次氯酸 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | CuS | KMnO4 | H2S具有还原性 | |
| D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |