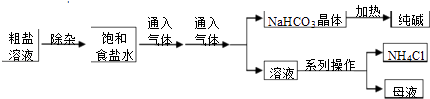
��Ŀ����
����Ŀ����ͼ��ʾ����Ԫ������A��B��C��D��E���ֻ����ԲȦ���沿��ָ���ֻ����ﺬ��һ����ͬԪ�أ����ֻ����������ֶ�����Ԫ���γɣ�ÿ�ֻ������������Ԫ�أ�A����������Ҫ�ɷ֣�B��E������������������Ϊ18��B���ȶ������н�ǿ�������ԣ���ϡ��Һ��ҽ���Ϲ㷺ʹ�õ���������E�ķ��ӽṹģ��Ϊ ![]() ��C����Ϊ���ά����Ҫ���ϣ�D����������Ԫ�ص�ԭ�Ӹ�����Ϊ3��4����������֮��Ϊ3��2������������Ϣ�ش��������⣺
��C����Ϊ���ά����Ҫ���ϣ�D����������Ԫ�ص�ԭ�Ӹ�����Ϊ3��4����������֮��Ϊ3��2������������Ϣ�ش��������⣺
��1��BΪ��Ԫ���ᣬ��ˮ��Һ�������ԣ���B��ˮ��Һ�ĵ�һ�����뷽��ʽ�ɱ�ʾΪ ��
��2��D�Ļ�ѧʽ�� �� E����ʽΪ ��
��3��Һ̬B��Һ̬E��Ӧ������һ����̬���ʺ�һ�ֳ���Һ�壬1molB�μӷ�Ӧ�ų�����QkJ���䷴Ӧ���Ȼ�ѧ����ʽ ��
��4��NH3�����е�Nԭ����һ�Թ¶Ե��ӣ��ܷ�����Ӧ��NH3+HCl=NH4Cl��E��NH3�������ƣ�Ҳ����HCl������Ӧ����д��E���������ᷢ����Ӧ�Ļ�ѧ����ʽ 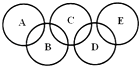
���𰸡�
��1��H2O2?HO2��+H+
��2��Si3N4��![]()
��3��2H2O2��l��+N2H4��l��=N2��g��+4H2O��l����H=��2Q kJ/mol
��4��N2H4+2HCl=N2H6Cl2
���������⣺A����������Ҫ�ɷ֣���AΪ���飻C����Ϊ���ά����Ҫ���ϣ���CΪSiO2��B����������������Ϊ18��B���ȶ������н�ǿ�������ԣ������顢���������к��е�Ԫ�أ���֪BΪH2O2��E����������������Ϊ18�����E�Ľṹģ�ͣ���֪E��������ԭ�ӹ��ɵķ��ӣ�ԭ��ƽ��������Ϊ3����E�к���HԪ�أ�EΪN2H4��D�к���SiԪ�أ�������HԪ�ػ�NԪ�أ���D������������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4����DΪSi3N4 �� ��1��BΪH2O2 �� ���ڶ�Ԫ���ᣬ��ˮ��Һ�������ԣ���H2O2��ˮ��Һ�ĵ�һ�����뷽��ʽ�ɱ�ʾΪ��H2O2HO2��+H+ �� ���Դ��ǣ�H2O2HO2��+H+����2��D�Ļ�ѧʽ��Si3N4 �� EΪN2H4 �� ����ʽΪ ![]() �����Դ��ǣ�Si3N4��
�����Դ��ǣ�Si3N4�� ![]() ����3��Һ̬H2O2��Һ̬N2H4��Ӧ������һ����̬���ʺ�һ�ֳ���Һ�壬Ӧ���ɵ�����ˮ��1molH2O2�μӷ�Ӧ�ų�����QkJ���䷴Ӧ���Ȼ�ѧ����ʽ��2H2O2��l��+N2H4��l��=N2��g��+4H2O��l����H=��2Q kJ/mol�����Դ��ǣ�2H2O2��l��+N2H4��l��=N2��g��+4H2O��l����H=��2Q kJ/mol����4��NH3�����е�Nԭ����һ�Թ¶Ե��ӣ��ܷ�����Ӧ��NH3+HCl=NH4Cl��N2H4��NH3�������ƣ�Ҳ����HCl������Ӧ��N2H4���������ᷢ����Ӧ�Ļ�ѧ����ʽ��N2H4+2HCl=N2H6Cl2 �� ���Դ��ǣ�N2H4+2HCl=N2H6Cl2 ��
����3��Һ̬H2O2��Һ̬N2H4��Ӧ������һ����̬���ʺ�һ�ֳ���Һ�壬Ӧ���ɵ�����ˮ��1molH2O2�μӷ�Ӧ�ų�����QkJ���䷴Ӧ���Ȼ�ѧ����ʽ��2H2O2��l��+N2H4��l��=N2��g��+4H2O��l����H=��2Q kJ/mol�����Դ��ǣ�2H2O2��l��+N2H4��l��=N2��g��+4H2O��l����H=��2Q kJ/mol����4��NH3�����е�Nԭ����һ�Թ¶Ե��ӣ��ܷ�����Ӧ��NH3+HCl=NH4Cl��N2H4��NH3�������ƣ�Ҳ����HCl������Ӧ��N2H4���������ᷢ����Ӧ�Ļ�ѧ����ʽ��N2H4+2HCl=N2H6Cl2 �� ���Դ��ǣ�N2H4+2HCl=N2H6Cl2 ��

 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�