题目内容
(9分)铜及其合金是人类最早使用的金属材料。
 (1)铜原子的核外电子排布式是 。
(1)铜原子的核外电子排布式是 。
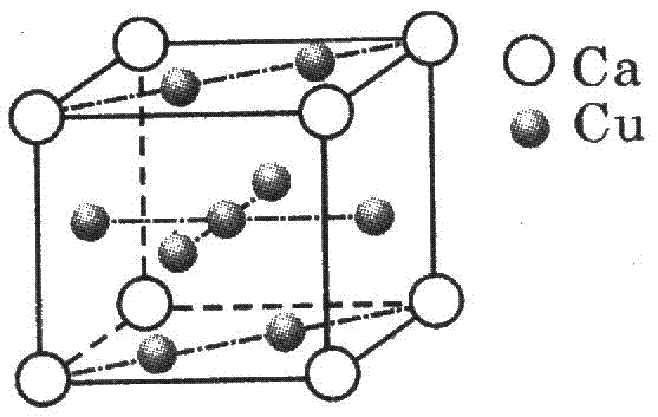
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 。
(3)Cu2+能与NH3、H2O、C1-等形成配位数为4的配合物。
①[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。
②某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
(4)CaO晶体的结构与NaCl相同,CaO晶体中Ca2+的配位数为 。
晶格能分别为:CaO为-3401 kJ?mol-1、NaCl为-786 kJ?mol-1。导致两者晶格能差异的主要原因是 。
(5)假定铁有简单立方、体心立方(bcp)、面心立方(ccp)三种同素异形体,三种晶体在不同温度下能发生相互转化。若三种同素异形体晶胞边长分别为a cm, b cm,c cm则三种晶体密度比为 。
(1)1s22s22p63s23p63d104s1;
(2)1:5;
(3)平面正方形;sp2;
(4)6;CaO晶体中离子电荷数大于NaC1,所以晶格能大;
(5)1/a3:12/b3:4/c3

 阅读快车系列答案
阅读快车系列答案
 物质的结构决定性质,性质反映其结构特点.
物质的结构决定性质,性质反映其结构特点.

