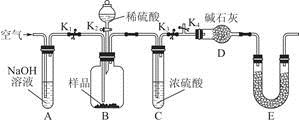
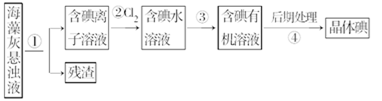
题目内容
必须通过加入其它试剂才能鉴别的一组无色溶液是
| A.氯化铝溶液和氢氧化钾溶液 | B.碳酸氢钠和稀盐酸 |
| C.偏铝酸钠溶液和稀硝酸 | D.碳酸钠和稀硫酸 |
B
试题分析:A、氯化铝和氢氧化钾相互滴加现象不同,KOH中加入氯化铝开始无现象,氯化铝中加入KOH开始有沉淀,然后沉淀溶解,可以鉴别,不需要再加试剂,错误;B、把碳酸氢钠加入到盐酸中或者把盐酸加入到碳酸氢钠中都有气体放出,无法鉴别,需要再加试剂,正确;C、偏铝酸钠和硝酸相互滴加现象不同,盐酸中加入偏铝酸钠开始无现象,偏铝酸钠中加入盐酸开始有沉淀,然后沉淀溶解,可以鉴别,不需要再加试剂,错误;D、碳酸钠中加入硫酸开始无现象,然后有气体生成,硫酸中加入碳酸钠有气体生成,不需要再加试剂,错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
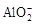 、
、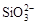 、
、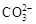 、
、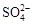 中的若干种离子。某同学对该溶有进行了如下实验:
中的若干种离子。某同学对该溶有进行了如下实验: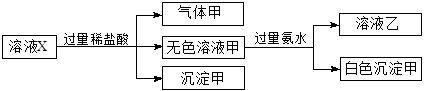

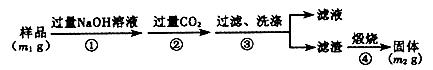

 ’
’