题目内容
【题目】某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。
氯气的颜色为__________;由氯的原子结构示意图推测,氯气具有很强的______ 性。为了证明推测是否正确,进行如下实验:
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是___________。
II:在空气中点燃H2,然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生______色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测_____(填“正确”或“不正确”)。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是_____。
A.Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
【答案】黄绿色 氧化 2Fe + 3Cl2![]() 2FeCl3 苍白 正确 D
2FeCl3 苍白 正确 D
【解析】
氯气为黄绿色气体,根据氯原子的原子结构示意图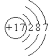 ,其最外层有7个电子,易得到1个电子达到8电子稳定结构,因此氯气具有很强的氧化性,故答案为:黄绿色;氧化;
,其最外层有7个电子,易得到1个电子达到8电子稳定结构,因此氯气具有很强的氧化性,故答案为:黄绿色;氧化;
Ⅰ.铁丝在氯气中燃烧生成氯化铁,故答案为:2Fe + 3Cl2![]() 2FeCl3;
2FeCl3;
Ⅱ.氢气在氯气中燃烧,发出苍白色火焰;实验Ⅰ、Ⅱ中氯气均体现氧化性,上述推测正确,故答案为:苍白;正确;
Ⅲ.氯水中,部分氯气与水发生反应Cl2+H2O=HCl+HClO,因此新制氯水中存在Cl2、HClO、HCl,Na2CO3会与HCl反应,FeCl2会与Cl2反应,AgNO3会与HCl反应,CuCl2不与氯水中的成分反应,故答案为:D。

【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D