题目内容
【题目】[化学—选修3:物质结构与性质]
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4。回答下列问题:
⑴写出基态Zn原子的价电子排布式__________,基态S原子核外未成对电子数为_____。
⑵ZnSO4中三种元素的电负性由大到小的顺序为_____________________,SO42-的立体构型为________________,其中S的杂化轨道类型为_________。
⑶硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,[Zn(NH3)4]SO4溶液中不存在的微粒间作用力有___________。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
⑷根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为___________;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
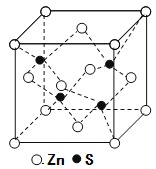
⑸立方ZnS晶体的密度为ρg·cm-3,其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
【答案】3d104s22O、S、Zn正四面体形sp3a离子晶体ZnCl2 、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔沸点升高。412![]()
【解析】
⑴Zn的核电荷数为30,基态Zn原子的电子排布式为[Ar]3d104s2,价电子排布式3d104s2,硫的核电荷数为16,电子排布式为1s22s22p63s23p4,3p轨道上有2个未成对电子;
⑵ZnSO4中三种元素为Zn、O、S,非金属性的强弱顺序为O>S,Zn为金属元素,则电负性由大到小的顺序为O>S>Zn,硫酸根中心原子的价层电子对为:孤对电子数![]() =0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;
=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;
(3)[Cu(NH3)4]SO4中存在离子键、共价键、配位键,不存在范德华力、金属键,答案为d;
⑷ZnF2晶体的熔点比ZnCl2、ZnBr2高,且不溶于有机溶剂,可判断晶体类型为离子晶体;ZnCl2 、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强ZnCl2、ZnBr2、ZnI2熔点依次增大的原因;
⑸在ZnS晶胞结构中S2-周围等距离且最近的Zn2+为4,S2-周围等距离且最近的S2-依次为12;ZnS晶胞中的晶胞参数a为xnm,则晶胞的体积为(x×10-6cm)3,晶胞中含有4个ZnS,则1mol晶胞的质量为97×4g,1mol晶胞的体积为(x×10-7cm)3×6.02×1023,则ZnS晶体的密度为ρg·cm-3=(97×4g)÷[(x×10-7cm)3×6.02×1023],解得x=![]() nm。
nm。