题目内容
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化磷的物质的量是
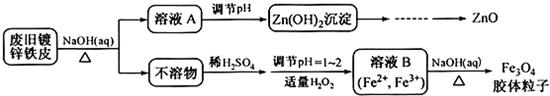
- A.
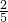 mol
mol - B.
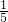 mol
mol - C.
 mol
mol - D.
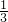 mol
mol
B
分析:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11mol P元素中6mol化合价升高(氧化)、5mol 化合价降低(还原),可见被氧化的6mol P,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol 被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15mol CuSO4所氧化的P为3mol,则1mol CuSO4氧化P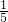 mol.
mol.
解答:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11mol P元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6mol P,是被Cu(+2)和另一部分P共同氧化的.
由电子得失数目可知,6mol 被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15mol CuSO4所氧化的P为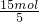 =3mol,则1mol CuSO4氧化P
=3mol,则1mol CuSO4氧化P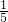 mol.
mol.
故选B.
点评:本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价判断氧化剂与还原剂,可以直接利用Cu(+2)得电子等于CuSO4氧化的磷得电子数守恒计算,更为简单.
分析:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11mol P元素中6mol化合价升高(氧化)、5mol 化合价降低(还原),可见被氧化的6mol P,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol 被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15mol CuSO4所氧化的P为3mol,则1mol CuSO4氧化P
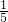 mol.
mol.解答:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11mol P元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6mol P,是被Cu(+2)和另一部分P共同氧化的.
由电子得失数目可知,6mol 被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15mol CuSO4所氧化的P为
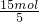 =3mol,则1mol CuSO4氧化P
=3mol,则1mol CuSO4氧化P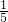 mol.
mol.故选B.
点评:本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价判断氧化剂与还原剂,可以直接利用Cu(+2)得电子等于CuSO4氧化的磷得电子数守恒计算,更为简单.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
 的物质的量浓度是
的物质的量浓度是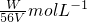
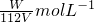
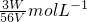
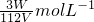
 (x+y)mol
(x+y)mol