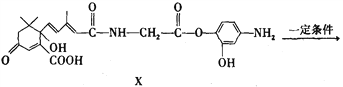
题目内容
【题目】某溶液中含H+、SO42﹣、NO3﹣三种离子,其中H+、SO42﹣的物质的量浓度分别为7.0molL﹣1和2.0molL﹣1 . 取该溶液20mL,加入3.2g铜粉,加热使它们充分反应,产生的气体在标准状况下的体积约为( )
A.0.75 L
B.0.336 L
C.1.5 L
D.0.448 L
【答案】A
【解析】解:其中H+、SO42﹣的物质的量浓度分别为7.0mol/L和2.0mol/L.由电荷守恒可知,NO3﹣的浓度为7.0mol/L﹣2.0mol/L×2=3mol/L,取该溶液20mL,H+、NO3﹣两种离子的物质的量分别为0.02L×7mol/L=0.14mol、0.02L×3mol/L=0.06mol,n(Cu)= ![]() =0.05mol,
=0.05mol,
由3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O可知,若0.05molCu完全反应,消耗氢离子为0.05mol× ![]() =0.133mol,消耗硝酸根离子为0.05mol×
=0.133mol,消耗硝酸根离子为0.05mol× ![]() =0.033mol,
=0.033mol,
若氢离子完全反应,则消耗Cu为0.14mol× ![]() =0.0525mol,消耗硝酸根离子为0.14mol×
=0.0525mol,消耗硝酸根离子为0.14mol× ![]() =0.035mol,
=0.035mol,
由上述计算可知,H+、NO3﹣均过量,Cu完全反应,设生成NO的物质的量为x,则
3Cu | +8H++2NO3﹣=3Cu2++ | 2NO↑ | +4H2O |
3 | 2 | ||
0.05mol | x |
![]() ,
,
解得x≈0.033mol,
所以收集到的气体在标况下体积是0.033mol×22.4L/mol=0.75L,
故选A.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目