题目内容
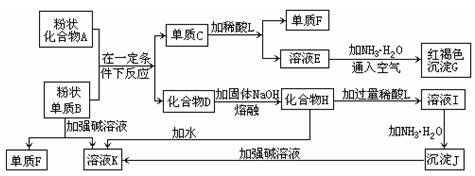
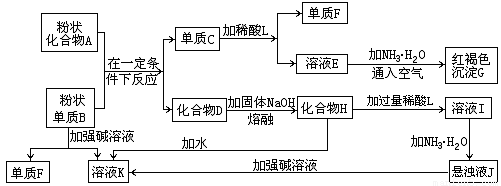
提示:某些金属氧化物跟熔融烧碱反应可生成盐.根据以下化学反应框图填空: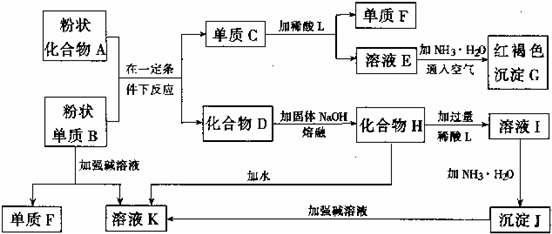
(1)单质F是
(2)写出由E生成G的离子反应方程式(或化学方程式)
(3)溶液I中所含金属离于是
(4)由C生成E、F,若改用浓酸,则不能选用的浓酸是(写分子式)

(1)单质F是
H2
H2
.(2)写出由E生成G的离子反应方程式(或化学方程式)
4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+
4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+
.(3)溶液I中所含金属离于是
Al3+和Na+
Al3+和Na+
.(4)由C生成E、F,若改用浓酸,则不能选用的浓酸是(写分子式)
H2SO4(或HNO3)
H2SO4(或HNO3)
.分析:溶液E和氨水、空气反应生成红褐色沉淀,红褐色沉淀是氢氧化铁,则E是亚铁盐;单质C和酸L反应生成E和单质F,E是亚铁盐,金属和酸反应生成盐,所以C是铁;沉淀J和强碱反应,则J是氢氧化铝,I和氨水反应生成氢氧化铝,所以I是铝盐;氢氧化铝和强碱反应生成溶液K,氢氧化铝和强碱反应生成偏铝酸盐,所以K是偏铝酸盐,单质B和强碱反应生成偏铝酸盐和氢气,则B是金属铝,F是氢气;化合物A和铝反应生成铁和化合物D,根据铝热反应知,A是铁的氧化物,D是氧化铝;高温条件下,氧化铝和熔融的氢氧化钠反应生成盐,K是偏铝酸盐,根据元素守恒知K是偏铝酸钠.
解答:解:溶液E和氨水、空气反应生成红褐色沉淀,红褐色沉淀是氢氧化铁,则E是亚铁盐;单质C和酸L反应生成E和单质F,E是亚铁盐,金属和酸反应生成盐,所以C是铁;沉淀J和强碱反应,则J是氢氧化铝,I和氨水反应生成氢氧化铝,所以I是铝盐;氢氧化铝和强碱反应生成溶液K,氢氧化铝和强碱反应生成偏铝酸盐,所以K是偏铝酸盐,单质B和强碱反应生成偏铝酸盐和氢气,则B是金属铝,F是氢气;化合物A和铝反应生成铁和化合物D,根据铝热反应知,A是铁的氧化物,D是氧化铝;高温条件下,氧化铝和熔融的氢氧化钠反应生成盐,K是偏铝酸盐,根据元素守恒知K是偏铝酸钠.
(1)通过以上分析知,F是H2,故答案为:H2;
(2)亚铁离子和氨水反应生成氢氧化亚铁、铵根离子,氢氧化亚铁和水、氧气生成氢氧化铁,所以总的离子方程式为:
4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+,故答案为:4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+;
(3)偏铝酸钠和过量酸反应生成钠盐、铝盐和水,所以溶液I中所含金属离子是钠离子和铝离子,故答案为:Al3+和Na+;
(4)由铁生成亚铁盐和氢气,若改为浓酸,则浓酸不是浓硫酸或浓硝酸,常温下,浓硝酸和浓硫酸能与铁发生钝化反应,生成铁盐不是亚铁盐,
故答案为:H2SO4(或HNO3).
(1)通过以上分析知,F是H2,故答案为:H2;
(2)亚铁离子和氨水反应生成氢氧化亚铁、铵根离子,氢氧化亚铁和水、氧气生成氢氧化铁,所以总的离子方程式为:
4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+,故答案为:4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+;
(3)偏铝酸钠和过量酸反应生成钠盐、铝盐和水,所以溶液I中所含金属离子是钠离子和铝离子,故答案为:Al3+和Na+;
(4)由铁生成亚铁盐和氢气,若改为浓酸,则浓酸不是浓硫酸或浓硝酸,常温下,浓硝酸和浓硫酸能与铁发生钝化反应,生成铁盐不是亚铁盐,
故答案为:H2SO4(或HNO3).
点评:本题考查元素化合物的特性和反应,用框图设问可以考查学生正向思维、逆向思维、发散和收敛思维,能根据题眼正确判断化合物是解本题的关键,注意常温下,浓硝酸和浓硫酸能与铁发生钝化反应,生成铁盐不是亚铁盐.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目