题目内容
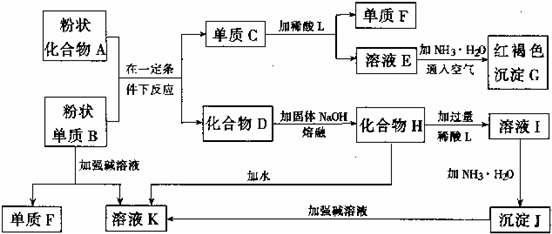
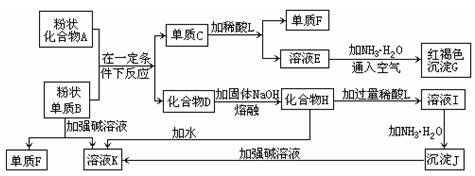
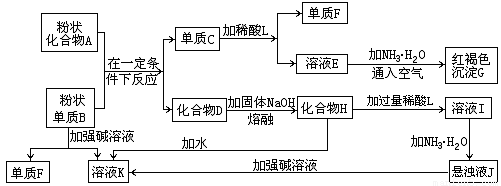
提示:某些金属氧化物跟熔融烧碱反应生成盐。根据以下化学反应框图填空:
(1)单质F是___________________________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)___________________。
(3)溶液I中所含金属离子是_____________________________。
(4)由C![]() E+F,若改用浓酸,则不能选用的浓酸是(写化学式)______________。
E+F,若改用浓酸,则不能选用的浓酸是(写化学式)______________。
解析:B可以与A反应得到单质C,由C可以转化为红褐色沉淀G,则G为Fe(OH)3,C为单质Fe;由于B可以与强碱溶液反应,并且可以从化合物A中还原出单质Fe,则B为铝,单质F为H2;C与稀酸L反应放出H2,则稀酸L为盐酸或硫酸,进而推断其他产物。由C![]() E+F时,若改用浓酸,显然不能选择氧化性酸(HNO3、浓H2SO4),一是因为浓HNO3、浓H2SO4会使Fe钝化,二是即使反应也得不到H2。
E+F时,若改用浓酸,显然不能选择氧化性酸(HNO3、浓H2SO4),一是因为浓HNO3、浓H2SO4会使Fe钝化,二是即使反应也得不到H2。
答案:(1)H2
(2)4Fe2++8NH3·H2O+O2+2H2O===4Fe(OH)3↓+8NH![]() 〔或Fe2++2NH3·H2O===Fe(OH)2↓+2NH
〔或Fe2++2NH3·H2O===Fe(OH)2↓+2NH![]() 、4Fe(OH)2+O2+2H2O===4Fe(OH)3〕
、4Fe(OH)2+O2+2H2O===4Fe(OH)3〕
(3)Al3+、Na+
(4)浓H2SO4、浓HNO3

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目