题目内容
5.如图为铜锌原电池示意图,下列说法正确的是( )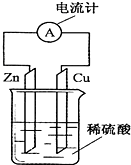
| A. | 锌片上有气泡产生 | B. | 烧杯中溶液逐渐呈蓝色 | ||
| C. | 电流由铜片通过导线流向锌片 | D. | 该装置能将电能转变为化学能 |
分析 由图中的铜锌原电池可知,Zn活泼,则Zn作负极,Cu作正极,发生电池反应为Zn+H2SO4═ZnSO4+H2↑,电子由负极流向正极,该装置将化学能转变为电能,以此来解答.
解答 解:A、因Zn作负极,则Zn失去电子而逐渐溶解,不会产生气泡,故A错误;
B、由发生电池反应为Zn+H2SO4═ZnSO4+H2↑,Cu不反应,则烧杯中溶液为无色,故B错误;
C、Zn作负极,Cu作正极,则电子由锌片通过导线流向铜片,电流由铜片通过导线流向锌片,故C正确;
D、该装置通过化学反应将化学能转变为电能,故D错误;
故选:C.
点评 本题考查原电池的工作原理,明确电极的判断、电极反应、电池反应、能量转化等即可解答,难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
15.生产、生活离不开化学,下列说法不正确的是( )
| A. | 不需要通过化学反应就能从海水中获得食盐和淡水 | |
| B. | 燃料电池的燃料都在负极发生氧化反应 | |
| C. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| D. | 工业上常用高纯硅制造光导纤维 |
16.用NA代表阿伏加德罗常数,下列表述正确的是( )
| A. | 1L 0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 标况下,22.4L辛烷完全燃烧生成二氧化碳分子为8NA | |
| C. | 1mol Na2O和1mol Na2O2晶体中离子总数均为3NA | |
| D. | 1mol羟基中电子数为10 NA |
13.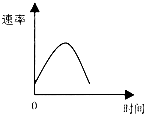 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率有影响的是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率有影响的是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度.
 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率有影响的是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率有影响的是( )①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度.
| A. | ①④ | B. | ③④ | C. | ①②③ | D. | ②③ |
20.下列关于实验原理或操作的叙述中,正确的是( )
| A. | 在铜锌原电池中,往电解质溶液(稀硫酸)中加入重铬酸钾或双氧水能使电池放电时间缩短 | |
| B. | 溶液的酸碱性、催化剂都对H2O2的稳定性有很大影响,新鲜的动物肝脏能加快H2O2的分解 | |
| C. | 在镀锌铁皮锌镀层厚度测定实验中,当铁皮在盐酸中充分反应至速率突然减小时,应立即将铁片取出,用酒精喷灯烘干 | |
| D. | 在食醋总酸含量测定中,用已知浓度的氢氧化钠溶液滴定,以甲基橙作为指示剂滴定至终点 |
10.铝热反应原理可以应用在生产上,例如焊接钢轨、冶炼难熔金属、制作传统的烟火剂等.某小组同学在研究铝热反应时,进行如下讨论和实验.
(1)关于铝热反应有以下两种认识,其中正确的是b(填字母序号).
a.该反应需在高温下发生,所以是吸热反应
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+Al2O3.
(3)铝和氧化铁反应所得固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是NaOH溶液.
③ii中生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(1)关于铝热反应有以下两种认识,其中正确的是b(填字母序号).
a.该反应需在高温下发生,所以是吸热反应
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+Al2O3.
(3)铝和氧化铁反应所得固体成分的初步确定.
| 实验序号 | 操作及现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2),溶液变为深红色 |
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是NaOH溶液.
③ii中生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
14.将一定量的Fe和Fe2O3的混合物放入250mL 1.8mol•L-1的硝酸溶液中,当固体混合物完全溶解后,在标准状况下生成1.12LNO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0mol?L-1NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积至少应为( )
| A. | 300mL | B. | 400mL | C. | 450mL | D. | 500mL |
15.将碘水中的碘萃取出来的实验中,下列说法错误的是( )
| A. | 分液漏斗使用前要检查它是否漏水 | |
| B. | 要求萃取剂既不溶于水,且比水更容易使碘溶解 | |
| C. | 分液漏斗注入碘水和萃取剂,反复倒转并用力振荡后,不必静置,应立即分液 | |
| D. | 分液时,下层液体应从下口放出,上层液体应从上口倒出 |
 写出氨气的结构式
写出氨气的结构式