题目内容
对溶液中的离子进行鉴定,下列实验所得结论不合理的是
| A.加入稀硝酸后,再加入AgNO3溶液,有白色沉淀生成,则说明原溶液中含有Cl- |
| B.加入KSCN溶液无红色出现,再加入氯水溶液变血红色,说明原溶液中一定含有Fe2+ |
| C.加入用稀硝酸酸化的Ba(NO3)2溶液产生白色沉淀,则可推断原溶液中一定含有SO42- |
| D.加入盐酸产生使澄清石灰水变浑浊的无色无味的气体,可推测原溶液中含有CO32-离子或HCO3- |
C
解:A.向溶液中加入稀硝酸后,再加入AgNO3溶液有白色沉淀生成,发生反应为Cl-+Ag+═AgCl↓,AgCl不溶于稀硝酸,可确定溶液中含有Cl-,故A合理;
B.KSCN溶液是用于检验Fe3+的试剂,向溶液中加入KSCN溶液,观察无明显现象,说明溶液中不含Fe3+.继续加入氯水,溶液变红色,说明溶液存在Fe3+,而只能是溶液中Fe2+的和加入的氯水反应生成,2Fe2++Cl2═2Fe3++2Cl-.所以溶液中一定含有Fe2+,故B合理;
C.加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀,证明含有氯离子,故C不合理;
D.根据题意,使澄清石灰水变浑浊的无色无味气体为CO2.而溶液中与盐酸反应产生CO2的离子有CO32-、HCO3-,反应为CO32-+2H+═CO2↑+H2O、HCO3-+H+═CO2↑+H2O.所以溶液中可能含有CO32-或HCO3-或两者都有,故D合理;
故选C.
B.KSCN溶液是用于检验Fe3+的试剂,向溶液中加入KSCN溶液,观察无明显现象,说明溶液中不含Fe3+.继续加入氯水,溶液变红色,说明溶液存在Fe3+,而只能是溶液中Fe2+的和加入的氯水反应生成,2Fe2++Cl2═2Fe3++2Cl-.所以溶液中一定含有Fe2+,故B合理;
C.加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀,证明含有氯离子,故C不合理;
D.根据题意,使澄清石灰水变浑浊的无色无味气体为CO2.而溶液中与盐酸反应产生CO2的离子有CO32-、HCO3-,反应为CO32-+2H+═CO2↑+H2O、HCO3-+H+═CO2↑+H2O.所以溶液中可能含有CO32-或HCO3-或两者都有,故D合理;
故选C.

练习册系列答案
相关题目
 离子如下表:
离子如下表: )与加NaOH溶液的体积(
)与加NaOH溶液的体积( )的关系如右图所示。则该溶液中确定含有的离子有_______________;
)的关系如右图所示。则该溶液中确定含有的离子有_______________;
 关系如下表所示,分析后回答下列问题:
关系如下表所示,分析后回答下列问题: mol
mol 可知:用酸性KMnO4溶液可检验绿矾
可知:用酸性KMnO4溶液可检验绿矾 是否变质
是否变质 可知:反应中HNO3表现酸性和氧化性
可知:反应中HNO3表现酸性和氧化性 可知:
可知: 的酸性比
的酸性比 强
强 可知:
可知: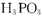 属于三元酸
属于三元酸